题目内容
3.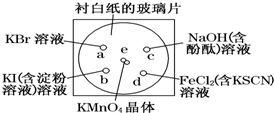 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O(1)e处反应的离子方程式为2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O
(2)b处的实验现象为溶液由无色变为蓝色,d处的实验现象为溶液变为红色.
(3)c处反应的化学方程式为Cl2+2NaOH═NaCl+NaClO+H2O.
(4)通过该实验得出Cl2、FeCl3、KMnO4三种物质的氧化性由强到弱的顺序是KMnO4>Cl2>FeCl3.
分析 (1)高锰酸钾具有强氧化性,能把盐酸氧化生成氯气,自身被还原生成氯化锰,据此写出反应方程式;
(2)b处氯气能置换出碘,碘遇淀粉变蓝色,氯化铁和硫氰化钾溶液反应使溶液呈血红色;
(3)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
(4)氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性.
解答 解:(1)e处产生黄绿色气体,说明生成氯气.由于有氯化锰生成,根据原子守恒还生成水,反应方程式为:2KMnO4+16HCl(浓)═2MnCl2+2KCl+5Cl2↑+8H2O,离子方程式为2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O,故答案为:2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O;
生成的氯气在a处与碘化钾反应,置换出碘,可观察到溶液由无色变为蓝色,生成的氯气在d处与氯化亚铁反应,将亚铁离子氧化为铁离子,可观察到溶液变为红色,
故答案为:溶液由无色变为蓝色;溶液变为红色;
(3)氯气与氢氧化钠反应生成氯化钠和次氯酸钠,反应的方程式为Cl2+2NaOH═NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH═NaCl+NaClO+H2O;
(4)氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,由e处反应可知氧化性为KMnO4>Cl2,由d处反应可知氧化性为Cl2>FeCl3,则氧化性由强弱顺序为KMnO4>Cl2>FeCl3,故答案为:KMnO4>Cl2>FeCl3.
点评 本题以氯气的性质为载体考查学生氧化还原反应的有关知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握相关物质的性质,难度不大.

练习册系列答案
相关题目
18.某强酸性反应体系中,反应物和生成物共六种物质:PbO2、PbSO4 (难溶盐)、Pb(MnO4)2(高锰酸铅强电解质)、H2O、X(水溶液呈无色)、H2SO4,已知X是一种盐,且0.1molX在该反应中应失去3.01×1023个电子.下列说法中不正确的是( )
| A. | 若有9.8gH2SO4参加反应,则转移电子的物质的量为1mol | |
| B. | 该反应的化学方程式为:5PbO2+2MnSO4+2H2SO4═Pb(MnO4)2+4PbSO4+2H2O | |
| C. | Pb(MnO4)2既是氧化产物又是还原产物 | |
| D. | X是MnSO4 |
8.铁、铜混合粉末18.0g加入到100mL 5.0mol•L-1FeCl3溶液中,充分反应后,剩余固体质量为2.8g.下列说法正确的是( )
| A. | 剩余固体是铜 | |
| B. | 原固体混合物中铜的质量是9.6g | |
| C. | 反应后溶液中n(Fe3+)=0.10mol | |
| D. | 反应后溶液中n(Fe2+)+n(Cu2+)=0.75mol |
15.辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(Cu2S),还有Fe203、Si02及一些不溶性杂质.一种以辉铜矿石为原料制备硝酸铜晶体的工艺流程如下:
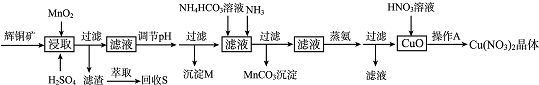
已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol.L-1计算).
回答下列问题:
(1)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O.
(2)调节pH的目的是铁离子转化成氢氧化铁完全沉淀,pH的调节范围为3.2≤pH<4.4.
(3)生成MnC03沉淀的离子方程式为Mn2++NH3+HCO3-=MnCO3↓+NH4+.
(4)操作A为蒸发浓缩、冷却结晶.
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+302 (g)═2Cu20(s)+2SO2(g)△H=-768.2kJ.mol-l
2Cu20(s)+Cu2S(s)═6Cu(s)+S02(g)△H=+116.O kJ.mol-l
则由Cu2S与02加热反应生成Cu的热化学方程式为Cu2S(s)+02(g)═2Cu(s)+SO2(g)△H=-217.4kJ.mol-l.
(6)若用含85% Cu2S的辉铜矿来制备无水Cu(N03)2.假设浸取率为95%,调节pH时损失Cu 3%,蒸氨过程中有5%未转化为Cu0,其它过程中无损耗,则1.0kg这样的辉铜矿最多能制备1.75kg无水Cu(N03)2.

已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol.L-1计算).
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O.
(2)调节pH的目的是铁离子转化成氢氧化铁完全沉淀,pH的调节范围为3.2≤pH<4.4.
(3)生成MnC03沉淀的离子方程式为Mn2++NH3+HCO3-=MnCO3↓+NH4+.
(4)操作A为蒸发浓缩、冷却结晶.
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+302 (g)═2Cu20(s)+2SO2(g)△H=-768.2kJ.mol-l
2Cu20(s)+Cu2S(s)═6Cu(s)+S02(g)△H=+116.O kJ.mol-l
则由Cu2S与02加热反应生成Cu的热化学方程式为Cu2S(s)+02(g)═2Cu(s)+SO2(g)△H=-217.4kJ.mol-l.
(6)若用含85% Cu2S的辉铜矿来制备无水Cu(N03)2.假设浸取率为95%,调节pH时损失Cu 3%,蒸氨过程中有5%未转化为Cu0,其它过程中无损耗,则1.0kg这样的辉铜矿最多能制备1.75kg无水Cu(N03)2.
12.下列叙述正确的是( )
| A. | Na2CO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| B. | 0.1 mol•L-1NH4Cl溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| C. | K2S溶液中:2c(K+)═c(H2S)+c(S2-)+c(HS-) | |
| D. | 相同浓度的CH3COOH和NaOH溶液等体积混合后,则:c(CH3COO-)+c(CH3COOH)═c(Na+) |
 铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物.
铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物.