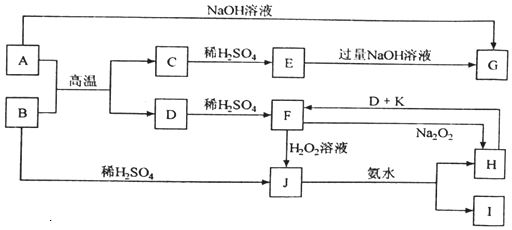
题目内容
11.NA表示阿伏伽德罗常数,下列叙述中正确的是( )| A. | 标准状况下,22.4L水中含有的水分子数为NA | |
| B. | 1mol Fe与足量的盐酸反应电子转移总数为3NA | |
| C. | 常温常压下,22g CO2中含有的氧原子数为NA | |
| D. | 500mL 1mol/L MgCl2溶液中含有Cl-数目为0.5NA |
分析 A.标准状况下水不是气体;
B.铁和盐酸反应生成氯化亚铁和氢气;
C.计算二氧化碳物质的量n=$\frac{m}{M}$,1mol二氧化碳含2mol氧原子;
D.离子浓度=溶质浓度×离子数,结合n=CV=$\frac{N}{{N}_{A}}$计算离子数;
解答 解:A.标准状况下,22.4L水物质的量不是1mol,不能计算含有的水分子数为NA,故A错误;
B.铁和盐酸反应生成氯化亚铁和氢气,1mol Fe与足量的盐酸反应电子转移总数为2NA,故B错误;
C.22g CO2中物质的量=$\frac{22g}{44g/mol}$=0.5mol,含有的氧原子数为NA,故C正确;
D.500mL 1mol/L MgCl2溶液中含有Cl-数目=1mol/L×2×0.5mol×NA=NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的计算、物质的量和微粒数计算关系分析、氧化还原反应电子转移等知识点,掌握基础是解题关键,题目难度中等.

练习册系列答案
 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
1.已知反应:aA(g)+bB(g)?cC(g),若其他条件不变时,改变某一条件对其平衡的影响的几种情况的图象(图中p表示压强,r表示温度,n表示物质的量,a表示平衡转化率,横坐标均为时间)如下.下列判断正确的是( )
| A. | 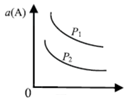 图:p1>p2,则此反应只能在高温下自发进行 | |
| B. |  图:此反应的△H<0,且T1<T2 | |
| C. |  图:表示t1时刻一定是使用催化剂对反应速率的影响 | |
| D. |  图:表示t1时刻增大B的浓度对反应速率的影响 |
19.反应4NH3(g)+5O2(g)→4NO(g)+6H2O(g),在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则反应的平均速度是( )
| A. | v(O2)=0.0125mol/(L•s) | B. | v(NO)=0.06mol/(L•s) | ||
| C. | v(NH3)=0.002mol/(L•s) | D. | v(H2O)=0.0003mol/(L•s) |
6.下列物质的变化,不能通过一步化学反应完成的是( )
| A. | S→SO3 | B. | Fe(OH)2→Fe(OH)3 | C. | N2→NH3 | D. | Na2O2→Na2CO3 |
7.将充有m mL NO和n mL NO2的量筒倒立于水槽中,然后通入m mL O2,若m<n,则充分反应后,量筒内气体的体积为(单位:mL)( )
| A. | 3(m-n) | B. | m+$\frac{n}{3}$ | C. | $\frac{n-m}{3}$ | D. | $\frac{4n-m}{12}$ |
5.下列说法不正确的是( )
| A. | 液氯可存储于钢瓶中运输和使用 | |
| B. | 氯水呈黄绿色,说明氯水中含有Cl2 | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ | |
| D. | 向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |