题目内容
5.下列说法不正确的是( )| A. | 液氯可存储于钢瓶中运输和使用 | |
| B. | 氯水呈黄绿色,说明氯水中含有Cl2 | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ | |
| D. | 向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
分析 A.干燥的氯气常温下与铁不反应;
B.只有氯气有颜色,为黄绿色;
C.能与碳酸氢钠反应有气泡产生说明具有酸性;
D.氯水中生成了盐酸和次氯酸,盐酸具有酸性,次氯酸具有强氧化性.
解答 解:A.干燥的氯气常温下与铁不反应,所以液氯可储存于钢瓶中,便于运输和使用,故A正确;
B.只有氯气有颜色,为黄绿色,氯水呈黄绿色是由于含有氯气,故B正确;
C.向氯水中加入NaHCO3粉末,有气泡产生即生成二氧化碳,所以具有酸性即氯水中含有H+,故C正确;
D.氯水中生成了盐酸和次氯酸,盐酸具有酸性,次氯酸具有强氧化性漂白,所以向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液先变红色后褪色,故D错误,
故选D.
点评 本题考查氯气以及氯水的性质,难度不大,侧重对基础知识的考查,需要学生熟练掌握基础知识.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
11.NA表示阿伏伽德罗常数,下列叙述中正确的是( )
| A. | 标准状况下,22.4L水中含有的水分子数为NA | |
| B. | 1mol Fe与足量的盐酸反应电子转移总数为3NA | |
| C. | 常温常压下,22g CO2中含有的氧原子数为NA | |
| D. | 500mL 1mol/L MgCl2溶液中含有Cl-数目为0.5NA |
16.如图所示的实验作,能达到相应目的是( )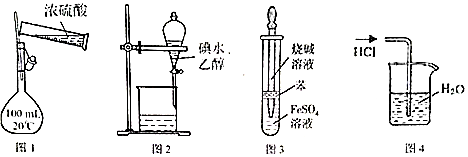

| A. | 用图1装置配制100 mL 0.1mol•L-1硫酸 | |
| B. | 用图2所示装置可萃取碘水中的碘 | |
| C. | 用图3所示装置可制备氢氧化亚铁 | |
| D. | 用图4所示装置可吸收HCl气体 |
13.下列仪器称为“干燥管”的是( )
| A. |  | B. |  | C. |  | D. |  |
20.下列试剂的保存方式正确的是( )
| A. | 漂白粉不需要密封保存 | |
| B. | FeCl2溶液保存时加入少量铁粉 | |
| C. | 镁条应保存在煤油中 | |
| D. | NaOH溶液应保存在配有玻璃塞的试剂瓶中 |
10.在无色强酸性溶液中,下列各组离子能大量共存的是( )
| A. | K+、Fe3+、SO42-、NO3- | B. | Na+、K+、NH4+、Cl- | ||
| C. | Ag+、Na+、NO3-、Cl- | D. | K+、Na+、ClO-、CO32- |
14.下列有关试剂的保存方法错误的是( )
| A. | 氢氧化钠溶液保存在具有玻璃塞的试剂瓶中 | |
| B. | 少量的钠保存在煤油中 | |
| C. | 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 浓硝酸保存在棕色玻璃试剂瓶中 |
10.我市中考实行网上阅卷,答题时必须用2B铅笔填涂答题卡,2B铅笔的主要成分是( )
| A. | 铅 | B. | 铅合金 | C. | 石墨 | D. | 木炭 |