题目内容
常温下,0.1mol?L-1CH3COONa溶液pH=11,下列表述正确的是( )
| A、c(Na+)=c(CH3COO-) |
| B、c(CH3COO-)+c(CH3COOH)=0.1 mol?L-1 |
| C、由水电离出来的c(OH-)=1.0×10-11 mol?L-1 |
| D、往该溶液中加入0.05 mol?L-1的CH3COONa,pH值变大 |
考点:离子浓度大小的比较,水的电离
专题:
分析:A、溶液中醋酸根离子水解显碱性、结合电荷守恒分析判断;
B、依据溶液中物料守恒分析判断;
C、结合溶液中离子积常数计算水电离出的氢离子浓度判断;
D、加水稀释,水解平衡正向进行,离子浓度减小.
B、依据溶液中物料守恒分析判断;
C、结合溶液中离子积常数计算水电离出的氢离子浓度判断;
D、加水稀释,水解平衡正向进行,离子浓度减小.
解答:
解:A、溶液中醋酸根离子水解显碱性、由电荷守恒可知c(H+)+c(Na+)=c(OH-)+c(CH3OO-),c(H+)<c(OH-),c(Na+)>c(CH3OO-),故A错误;
B、由溶液中物料守恒可知,c(CH3COO-)+c(CH3COOH)=0.1 mol?L-1,故B正确;
C、结合溶液中离子积常数计算水电离出的氢离子浓度,由水电离出来的c(OH-)=
=1.0×10-3 mol?L-1,故C错误;
D、加水稀释,水解平衡正向进行,离子浓度减小,氢氧根离子浓度减小,pH减小,故D错误;
故选B.
B、由溶液中物料守恒可知,c(CH3COO-)+c(CH3COOH)=0.1 mol?L-1,故B正确;
C、结合溶液中离子积常数计算水电离出的氢离子浓度,由水电离出来的c(OH-)=
| 10-14 |
| 10-11 |
D、加水稀释,水解平衡正向进行,离子浓度减小,氢氧根离子浓度减小,pH减小,故D错误;
故选B.
点评:本题考查了盐类水解的分析判断,主要是影响水解平衡因素的分析判断,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
现有下列5个转化,其中不可能通过一步反应实现的是( )
①Al2O3→Al;②CuSO4-→CuCl2;③SiO2-→H2SiO3 ;④CuO-→Cu(OH)2;⑤Na2O2-→NaOH.
①Al2O3→Al;②CuSO4-→CuCl2;③SiO2-→H2SiO3 ;④CuO-→Cu(OH)2;⑤Na2O2-→NaOH.
| A、①② | B、③④ |
| C、②③④ | D、②③④⑤ |
NA表示阿伏加德罗常数,下列说法中正确的是( )
| A、1 mol FeI2与足量氯气反应时转移的电子数为2NA |
| B、标准状况下,5.6L丙烷中含有共价键的数目为2NA |
| C、16g由氧气和臭氧组成的混合物中含有的分子总数为0.5 NA |
| D、0.1 mol乙烯和乙醇的混合物完全燃烧所消耗的氧原子数一定为0.6NA |
对于苯乙烯( )的下列叙述:①能使酸性KMnO4溶液褪色②可发生加聚反应;③可溶于水④可溶于苯中⑤能与浓硝酸发生取代反应⑥所有的原子可能共平面,其中正确的是( )
)的下列叙述:①能使酸性KMnO4溶液褪色②可发生加聚反应;③可溶于水④可溶于苯中⑤能与浓硝酸发生取代反应⑥所有的原子可能共平面,其中正确的是( )
 )的下列叙述:①能使酸性KMnO4溶液褪色②可发生加聚反应;③可溶于水④可溶于苯中⑤能与浓硝酸发生取代反应⑥所有的原子可能共平面,其中正确的是( )
)的下列叙述:①能使酸性KMnO4溶液褪色②可发生加聚反应;③可溶于水④可溶于苯中⑤能与浓硝酸发生取代反应⑥所有的原子可能共平面,其中正确的是( )| A、①②④⑤ | B、①②⑤⑥ |
| C、①②④⑤⑥ | D、全部正确 |
某合金粉末11g,加入到足量的稀硫酸中,在标准状况下产生的气体体积为11.2L,此合金可能是( )
| A、Mg、Al合金 |
| B、Cu、Zn合金 |
| C、Zn、Fe合金 |
| D、Mg、Zn合金 |
 标出原电池的电极材料和电解质溶液,并写出负极的电极反应为
标出原电池的电极材料和电解质溶液,并写出负极的电极反应为
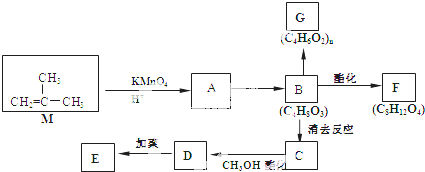
 结构的有机物可被酸性高锰酸钾溶液氧化成二元醇,如:CH2=CH2
结构的有机物可被酸性高锰酸钾溶液氧化成二元醇,如:CH2=CH2 )为原料合成环状化合物F和高分子化合物E和G.
)为原料合成环状化合物F和高分子化合物E和G.