题目内容
NA表示阿伏加德罗常数,下列说法中正确的是( )
| A、1 mol FeI2与足量氯气反应时转移的电子数为2NA |
| B、标准状况下,5.6L丙烷中含有共价键的数目为2NA |
| C、16g由氧气和臭氧组成的混合物中含有的分子总数为0.5 NA |
| D、0.1 mol乙烯和乙醇的混合物完全燃烧所消耗的氧原子数一定为0.6NA |
考点:阿伏加德罗常数
专题:
分析:A.氯气足量二价铁离子、碘离子都被氧化;
B.1个丙烷分子中含有8个C-H键和2个C-C键;
C.根据氧气的摩尔质量为32g/mol,臭氧的摩尔质量为48g/mol;
D.乙烯和乙醇结构特征的C2H4、C2H4 ?H2O特点分析计算耗氧量.
B.1个丙烷分子中含有8个C-H键和2个C-C键;
C.根据氧气的摩尔质量为32g/mol,臭氧的摩尔质量为48g/mol;
D.乙烯和乙醇结构特征的C2H4、C2H4 ?H2O特点分析计算耗氧量.
解答:
解:A.1 mol FeI2与足量氯气反应:3Cl2+2Fe2++4I-=2Fe3++6Cl-+2I2,转移3mol电子,电子数为3NA,故A错误;
B.1个丙烷分子中含有8个C-H键和2个C-C键,丙烷中共价键数为10个,5.6L物质的量为0.25mol,故共价键共2.5mol,个数2.5NA,故B错误;
C.氧气与臭氧的摩尔质量不同,氧气和臭氧组成的混合物中含有的分子总数无法计算,故C错误;
D.根据化学式C2H4、C2H4 ?H2O特点,可以看作求0.1mol乙烯完全燃烧消耗氧气为0.3mol,则氧原子数为0.6 NA.0.1mol乙烯和乙醇的混合物完全燃烧所消耗的氧原子数一定为0.6NA,故D正确;
故选:D.
B.1个丙烷分子中含有8个C-H键和2个C-C键,丙烷中共价键数为10个,5.6L物质的量为0.25mol,故共价键共2.5mol,个数2.5NA,故B错误;
C.氧气与臭氧的摩尔质量不同,氧气和臭氧组成的混合物中含有的分子总数无法计算,故C错误;
D.根据化学式C2H4、C2H4 ?H2O特点,可以看作求0.1mol乙烯完全燃烧消耗氧气为0.3mol,则氧原子数为0.6 NA.0.1mol乙烯和乙醇的混合物完全燃烧所消耗的氧原子数一定为0.6NA,故D正确;
故选:D.
点评:本题考查了阿伏伽德罗常数的分析应用,熟练掌握公式的使用和物质的结构是解题关键,注意有机物燃烧耗氧量规律,题目难度不大.

练习册系列答案
相关题目
常温下,0.1mol?L-1CH3COONa溶液pH=11,下列表述正确的是( )
| A、c(Na+)=c(CH3COO-) |
| B、c(CH3COO-)+c(CH3COOH)=0.1 mol?L-1 |
| C、由水电离出来的c(OH-)=1.0×10-11 mol?L-1 |
| D、往该溶液中加入0.05 mol?L-1的CH3COONa,pH值变大 |
下列图示与对应的叙述相符的是( )
A、 图表示催化剂能改变化学反应的焓变 |
B、 图表示向氨水中加水时溶液导电性的变化情况,且溶液c(OH-)大小:a<b |
C、 由图可知反应2A(g)+B(g)?C(g)的△H>O,且 a=2 |
D、 图表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化情况 |
一种微生物燃料电池的结构示意图如下所示,关于该电池的叙述正确的是( )
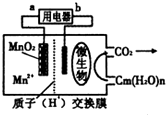

| A、电池工作时,电子由a流向b |
| B、微生物所在电极区放电时发生还原反应 |
| C、放电过程中,H+从正极区移向负极区 |
| D、正极反应式为:MnO2+4H++2e-═Mn2++2 H2O |
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )| A、该电池工作时电能转化为化学能 |
| B、该电池中电极a是正极 |
| C、外电路中电子由电极a通过导线流向电极b |
| D、该电池的总反应:2H2+O2=2H2O |
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A、1mol[Cu(NH3)2]2+中含有σ键的数目为12NA |
| B、0.1mol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA |
| C、分子数目为0.1NA的N2和NH3混合气体,原子间含有的公共电子数目为0.3NA |
| D、用惰性电极电解CuSO4溶液一段时间后,若加入0.05mol的Cu2(OH)2CO3固体恰好能使溶液恢复到原来的浓度,则该电解过程中转移电子的数目为0.2NA |
下列各化学式中,只表示一种纯净物的是( )
| A、C2H4O2 |
| B、C3H6 |
| C、C2H3Br |
| D、C |

