题目内容
实验室需要480mL0.1mol/LNa2CO3溶液,现用碳酸钠晶体配制,回答下列问题
(1)应用托盘天平称取十水合碳酸钠(Na2CO3?10H2O)晶体 g.
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,1g以下用游码,天平平衡时,则实际称量的十水合碳酸钠质量 (填偏高、偏低、不变).
(3)配制Na2CO3溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、
、 .
(4)若实验遇下列情况,溶液的浓度将会(填偏高、偏低、不变)
A、加水定容时俯视刻度线
B、容量瓶内壁附有水珠而未干燥处理
C、颠倒摇匀后发现凹液面低于刻度线又加水补上
D、称量的碳酸钠晶体部分失结晶水
(5)若定容是加水超过了刻度线,正确的处理方法是
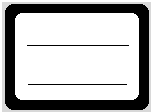
(6)请你帮助把标签上的内容写一下(如图).
(1)应用托盘天平称取十水合碳酸钠(Na2CO3?10H2O)晶体
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,1g以下用游码,天平平衡时,则实际称量的十水合碳酸钠质量
(3)配制Na2CO3溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、
(4)若实验遇下列情况,溶液的浓度将会(填偏高、偏低、不变)
A、加水定容时俯视刻度线
B、容量瓶内壁附有水珠而未干燥处理
C、颠倒摇匀后发现凹液面低于刻度线又加水补上
D、称量的碳酸钠晶体部分失结晶水
(5)若定容是加水超过了刻度线,正确的处理方法是
(6)请你帮助把标签上的内容写一下(如图).

考点:配制一定物质的量浓度的溶液
专题:
分析:(1)根据n=cv计算溶质Na2CO3的物质的量,利用Na2CO3?10H2O的物质的量等于Na2CO3的物质的量,根据m=nM计算Na2CO3?10H2O的质量;
(2)根据天平的称量原理;
(3)根据实验操作的步骤以及每步操作需要仪器确定所需仪器;
(4)根据c=
分析操作对溶质的物质的量或对溶液的体积的影响判断;
(5)配制过程中的操作失误,能补救就补救,不能补救就需重新配制;
(6)标签上的内容应注明物质的名称和浓度.
(2)根据天平的称量原理;
(3)根据实验操作的步骤以及每步操作需要仪器确定所需仪器;
(4)根据c=
| n |
| V |
(5)配制过程中的操作失误,能补救就补救,不能补救就需重新配制;
(6)标签上的内容应注明物质的名称和浓度.
解答:
解:(1)因配制溶液的体积为480ml,而容量瓶的规格没有480ml,只能选用500ml,Na2CO3的物质的量n=cV=0.5L×0.1mol?L-1=0.05mol,Na2CO3?10H2O的物质的量等于Na2CO3的物质的量,所以Na2CO3?10H2O的质量0.05mol×286g/mol=14.3g,故答案为:14.3;
(2)因天平的称量原理:左盘物体的质量=右盘物体的质量+游码的读数,一但物体和砝码位置反了,读数时用到了游码,则称得的实际质量减小,故答案为:偏低;
(3)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
故答案为:500mL容量瓶;胶头滴管;
(4)A、加水定容时俯视刻度线,则溶液体积偏大,则浓度偏低,故答案为:偏低;
B、容量瓶内壁附有水珠而未干燥处理,溶液的体积不变,浓度不变,故答案为:不变;
C、颠倒摇匀后发现凹液面低于刻度线是正常的,又加水补上则浓度偏低,故答案为:偏低;
E、称量的碳酸钠晶体部分失水,溶质的质量偏大,浓度偏高,故答案为:偏高.
(5)定容是加水超过了刻度线,是无法补救的,故应重新配制,故答案为:重新配制;
(6)标签上的内容为:Na2CO3溶液,0.1mol/L,故答案为: .
.
(2)因天平的称量原理:左盘物体的质量=右盘物体的质量+游码的读数,一但物体和砝码位置反了,读数时用到了游码,则称得的实际质量减小,故答案为:偏低;
(3)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
故答案为:500mL容量瓶;胶头滴管;
(4)A、加水定容时俯视刻度线,则溶液体积偏大,则浓度偏低,故答案为:偏低;
B、容量瓶内壁附有水珠而未干燥处理,溶液的体积不变,浓度不变,故答案为:不变;
C、颠倒摇匀后发现凹液面低于刻度线是正常的,又加水补上则浓度偏低,故答案为:偏低;
E、称量的碳酸钠晶体部分失水,溶质的质量偏大,浓度偏高,故答案为:偏高.
(5)定容是加水超过了刻度线,是无法补救的,故应重新配制,故答案为:重新配制;
(6)标签上的内容为:Na2CO3溶液,0.1mol/L,故答案为:
 .
.
点评:本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
相关题目
已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高,下列溶液沸点最高的是( )
| A、0.01 mol?L-1的蔗糖溶液 |
| B、0.01 mol?L-1的CaCl2溶液 |
| C、0.02 mol?L-1的NaCl溶液 |
| D、0.02 mol?L-1的氨水 |
用一定物质的量浓度的BaCl2溶液,使物质的量浓度相同的FeSO4溶液和Fe2(SO4)3溶液中的SO42-完全沉淀.如果所用的BaCl2溶液的体积比为1:2,则FeSO4和Fe2(SO4)3溶液的体积比为( )
| A、1:1 | B、1:3 |
| C、3:1 | D、3:2 |
以下实验原理或操作中,正确的是( )
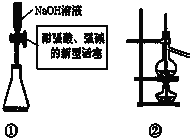

| A、装置①量取15.00 mLNaOH溶液 |
| B、装置②既可用于乙醇制乙烯的发生装置,又可用于分离沸点相差较大的互溶液体混合物 |
| C、室温下,含有CoCl2的干燥变色硅胶呈蓝色,在潮湿的空气中变粉红色,放在干燥的空气中又恢复为蓝色 |
| D、纸层析法分离铁离子和铜离子实验中,展开剂的成份为蒸馏水与丙酮 |
分析下表中各项的排布规律,有机物X是按此规律排布的第19项,下列有关X的结构和性质说法中一定错误的是
( )
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | CH2O | CH2O2 | CH4O | C2H6 | C2H4O | C2H4O2 | C2H6O |
| A、是戊酸,同分异构体有4种 |
| B、是酯,在稀硫酸条件下水解的两种产物的相对分子质量不可能相等 |
| C、可以发生银镜反应 |
| D、可以与溴水发生加成反应 |
