题目内容
19.有关下列电化学装置的说法中正确的是( )| A. |  图是原电池装置,可以实现化学能转化为电能 | |
| B. |  图电解一段时间后,加入适量CuO固体,可以使硫酸铜溶液恢复到原浓度 | |
| C. |  图中的X极若为负极,则该装置可实现粗铜的精炼 | |
| D. |  图中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀 |
分析 A.含有盐桥的原电池中,电极材料和电解质溶液含有相同的金属元素;
B.根据“析出什么物质加入什么物质”的原则判断;
C.电解精炼时,粗铜作阳极,纯铜作阴极;
D.铁作原电池正极时属于“牺牲阳极的阴极保护法”.
解答 解:A.图中铜电极应该插在硫酸铜溶液中,银电极应该插在硝酸银溶液中,故A错误;
B.图中石墨与电源的正极相连,做阳极,溶液中的OH-放电,生成氧气,铜电极和电源的负极相连,做阴极,溶液中的铜离子首先放电,生成铜,电解一段时间后,加入适量CuO固体,可以使硫酸铜溶液恢复到原浓度,故B正确;
C.电解精炼时,粗铜作阳极,纯铜作阴极,图中如果X是负极,则应该连接纯铜,粗铜应该和电源的正极相连,故C错误;
D.图中有外接的电源,该装置是“外加电流的阴极保护法”,故D错误;
故选B.
点评 本题考查原电池和电解池原理,根据金属的腐蚀及保护、粗铜的精炼、电解原理等知识来分析解答,难度不大.

练习册系列答案
相关题目
10.下列有关实验叙述正确的是( )
| A. | 向1 mol•L-1 AlCl3溶液中加过量的6 mol•L-1 NaOH溶液可制备Al(OH)3悬浊液 | |
| B. | 气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+ | |
| D. | 向含有少量Fe3+的CuSO4溶液中加入铜片可除去Fe3+ |
7.将盛有NH4HCO3的试管加热,使放出的气体依次通过盛有足量Na2O2的干燥管、足量浓硫酸的洗气瓶,最后得到的气体是( )
| A. | O2 | B. | NH3 | C. | H2O | D. | CO2 |
14.A、B两种烃,它们含碳质量分数相同,下列关于A和B的叙述正确的是( )
| A. | A和B最简式一定相同 | B. | A和B不可能是同系物 | ||
| C. | A和B一定是同分异构体 | D. | A和B的化学性质相似 |
11.下列各组物质不属于同分异构体的是( )
| A. | 2,2-二甲基-1-溴丙烷和2-甲基-2-溴丁烷 | |
| B. | 1,2-二甲苯和对二甲苯 | |
| C. | 2-甲基丁烷和戊烷 | |
| D. | 1-丁烯和1,3-丁二烯 |
8.下列说法不正确的是( )
| A. | 用新制氢氧化铜悬浊液可以鉴别乙酸、葡萄糖和淀粉三种溶液 | |
| B. | 用重铬酸钾溶液检验司机是否酒驾所发生的反应属于乙醇的氧化反应 | |
| C. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| D. | 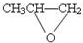 和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物 ,该反应不符合绿色化学原则 ,该反应不符合绿色化学原则 |
9.下列实验能达到目的是( )
| A. | 只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 | |
| B. | 将NH4Cl溶液蒸干可制备NH4Cl固体 | |
| C. | 测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热 | |
| D. | 浓硝酸应保存在棕色试剂瓶中,氢氟酸不能保存在玻璃瓶中 |
 .
. .
. .
. .
.