题目内容
10.下列有关实验叙述正确的是( )| A. | 向1 mol•L-1 AlCl3溶液中加过量的6 mol•L-1 NaOH溶液可制备Al(OH)3悬浊液 | |
| B. | 气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+ | |
| D. | 向含有少量Fe3+的CuSO4溶液中加入铜片可除去Fe3+ |
分析 A.Al(OH)3能溶于强碱NaOH溶液;
B.水能使无水CuSO4变蓝色;
C.K元素的焰色反应必须透过蓝色钴玻璃观察;
D.Cu和Fe3+反应生成Fe2+.
解答 解:A.Al(OH)3能溶于强碱NaOH溶液,但不溶于弱碱溶液,所以用氨水和AlCl3制备Al(OH)3悬浊液,故A错误;
B.水能使无水CuSO4变蓝色,如果某气体能使无水硫酸铜变蓝色,说明该气体是水蒸气,故B正确;
C.K元素的焰色反应必须透过蓝色钴玻璃观察,滤去黄光的干扰,该实验没有透过蓝色钴玻璃观察,所以不能确定是否含有K元素,故C错误;
D.Cu和Fe3+反应生成Fe2+,引进新的杂质,铁离子水解,加CuO与水解生成的氢离子反应促进水解,从而使铁离子转化为沉淀,所以应该加入CuO除去杂质,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、除杂、物质检验等知识点,明确实验原理及物质性质差异性是解本题关键,注意除杂时要除去杂质且不能引进新的杂质,易错选项是D.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
5.下列有关化学用语使用正确的是( )
| A. | 次氯酸的结构式为:H-Cl-O | B. | CO2的比例模型 | ||
| C. | NH4Cl的电子式: | D. | H2F+的电子式: |
15.下列关于物质鉴别的方法中不正确的是( )
| A. | 可用酸性高锰酸钾溶液鉴别甲烷和乙烯气体 | |
| B. | 可用淀粉溶液鉴别KI和KBr溶液 | |
| C. | 可用澄清石灰水检验H2和CH4的燃烧产物 | |
| D. | 可用溴水鉴别苯和四氯化碳 |
2.茶叶中含有多种有益于人体健康的有机成分及钙、铁等微量金属元素,某化学研究性学习小组设计方案测定某品牌茶叶中钙元素的质量分数,并检验铁元素的存在(已知CaC2O4为白色沉淀物质).首先取200g茶叶样品焙烧得灰粉后进行如图操作:

请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为:
实验前要先将茶叶样品高温灼烧成灰粉,其主要目的使样品中的有机物完全分解,将钙、铁等微量元素转化为可溶性物质.
(2)写出从滤液A→沉淀D的离子反应方程式Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
(3)为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,试判断沉淀D已经洗涤干净的方法是取少量最后一次洗涤液于试管中,滴加碳酸钠溶液,若无白色沉淀则说明沉淀已洗涤干净.
(4)用KMnO4标准溶液滴定C溶液时所发生的反应为:5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O.
现将滤液C稀释至500mL,再取其中的25.00mL溶液,用硫酸酸化后,用0.1000mol•L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00mL.
①此步操作过程中需要用到图2中哪些仪器(填写序号)B、C、D;

②滴定到终点,静置后,如图3方法读取KMnO4标准溶液的刻度数据,则测定的钙元素含量将偏高(填“偏高”“偏低”或“无影响”).
(5)原茶叶中钙元素的质量分数为0.3%.
(6)可以通过检验滤液A来验证该品牌茶叶中是否含有铁元素,所加试剂及现象是加入KSCN溶液,溶液呈红色.

请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为:
| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 4.1 |
(2)写出从滤液A→沉淀D的离子反应方程式Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
(3)为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,试判断沉淀D已经洗涤干净的方法是取少量最后一次洗涤液于试管中,滴加碳酸钠溶液,若无白色沉淀则说明沉淀已洗涤干净.
(4)用KMnO4标准溶液滴定C溶液时所发生的反应为:5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O.
现将滤液C稀释至500mL,再取其中的25.00mL溶液,用硫酸酸化后,用0.1000mol•L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00mL.
①此步操作过程中需要用到图2中哪些仪器(填写序号)B、C、D;

②滴定到终点,静置后,如图3方法读取KMnO4标准溶液的刻度数据,则测定的钙元素含量将偏高(填“偏高”“偏低”或“无影响”).
(5)原茶叶中钙元素的质量分数为0.3%.
(6)可以通过检验滤液A来验证该品牌茶叶中是否含有铁元素,所加试剂及现象是加入KSCN溶液,溶液呈红色.
19.有关下列电化学装置的说法中正确的是( )
| A. |  图是原电池装置,可以实现化学能转化为电能 | |
| B. |  图电解一段时间后,加入适量CuO固体,可以使硫酸铜溶液恢复到原浓度 | |
| C. |  图中的X极若为负极,则该装置可实现粗铜的精炼 | |
| D. |  图中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀 |


 ,D中含有的官能团的名称羧基、羟基.
,D中含有的官能团的名称羧基、羟基.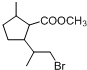 +2NaOH$→_{水}^{△}$
+2NaOH$→_{水}^{△}$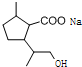 +CH3OH+NaBr.
+CH3OH+NaBr. )的路线补全完整:
)的路线补全完整:
 ,Y的空间构型为V形.
,Y的空间构型为V形.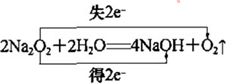 .
.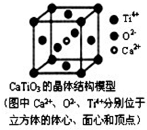 下列关于晶体的说法正确的组合是( )
下列关于晶体的说法正确的组合是( ) 一家人其乐融融地坐在大彩电前欣赏精彩的电视剧是一件很温馨的事情,带给我们幸福的大彩电离不开高分子物质,其中制造彩电荧光屏的高分子材料具有感光性,称为“光敏性高分子”,其结构简式如图所示.
一家人其乐融融地坐在大彩电前欣赏精彩的电视剧是一件很温馨的事情,带给我们幸福的大彩电离不开高分子物质,其中制造彩电荧光屏的高分子材料具有感光性,称为“光敏性高分子”,其结构简式如图所示. ,该单体可由
,该单体可由 和CH2=CH-OH经酯化(或取代)反应(填反应类型)得到.
和CH2=CH-OH经酯化(或取代)反应(填反应类型)得到.