题目内容
在一个固定容积的密闭容器中,加入a molA、b molB,发生aA(g)+bB(g)?pC(g),且a+b≠p,则处于平衡状态的标志是( )
| A、c(A)=c(B)=c(C) |
| B、单位时间消耗a molA同时消耗b molB |
| C、混合气体的压强保持不变 |
| D、混合气体的密度保持不变 |
考点:化学平衡状态的判断
专题:化学平衡专题
分析:化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论.
解答:
解:aA(g)+bB(g)?pC(g),且a+b≠p,
A.平衡时各物质的物质的量浓度的大小关系取决于物质的起始物质的量和转化率,故c(A)=c(B)=c(C)不能作为判断是否达到平衡状态的依据,故A错误;
B.单位时间消耗a molA是正反应,同时消耗b molB也是正反应,故B错误;
C.反应前后气体的体积不等,故混合气体的压强保持不变可作为判断是否达到化学平衡状态的依据,故C正确;
D.密度=
,总质量一定,体积一定,故密度一定,故混合气体的密度保持不变不能作为判断是否达到平衡状态的依据,故D错误,
故选C.
A.平衡时各物质的物质的量浓度的大小关系取决于物质的起始物质的量和转化率,故c(A)=c(B)=c(C)不能作为判断是否达到平衡状态的依据,故A错误;
B.单位时间消耗a molA是正反应,同时消耗b molB也是正反应,故B错误;
C.反应前后气体的体积不等,故混合气体的压强保持不变可作为判断是否达到化学平衡状态的依据,故C正确;
D.密度=
| 总质量 |
| 体积 |
故选C.
点评:本题考查化学平衡状态的判断,题目难度不大.要注意把握平衡状态的特征.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、常温下,0.01mol/LCH3COOH与pH=12的NaOH溶液混合,若混合后c(CH3COO-)>c(Na+),则混合液一定呈碱性 |
| B、常温下,将等体积0.01mol/LHCl与pH=12的氨水混合,则混合液的pH=7 |
| C、0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2c(H2A)+2c(HA?)+2c(A2-) |
| D、将5 mL 0.02mol/L的H2SO4与5 mL 0.02mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH=2 |
下列说法不正确的是( )
| A、苯甲醛在一定条件下能发生银镜反应 |
| B、用溴水即可鉴别苯酚溶液、2,4-己二烯和甲苯 |
| C、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| D、乙酸乙酯和食用植物油均可水解生成乙醇 |
设NA表示阿伏加德罗常数,下列说法正确的是( )
| A、1 mol氦气中有2NA个氦原子 |
| B、14 g氮气中含NA个氮原子 |
| C、2 L 0.3 mol?L-1 Na2SO4溶液中含0.6 NA个Na+ |
| D、18 g水中所含的电子数为8NA |
用铁片与50mL1mol/L的硫酸反应制取H2时,下列措施不能使氢气生成速率加大的是( )
| A、对该反应体系加热 |
| B、滴加几滴浓硫酸 |
| C、加入少量CH3COONa固体 |
| D、不用铁片,改用铁粉 |
设NA表示阿伏加德罗常数,下列说法错误的是( )
| A、一定量的Fe与含1 mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA |
| B、1 L 1 mol/L的FeCl3溶液中含有NA个Fe3+ |
| C、常温常压下,等质量的SO2、S2含有相同的分子数 |
| D、125 g CuSO4?5H2O晶体中含有0.5NA个Cu2+ |
下列实验操作或对实验事实的描述中正确的有( )
| A、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| B、做银镜反应后试管壁上银镜,用稀氨水洗涤 |
| C、将0.1 mol/L的NaOH溶液与0.5 mol/L的CuSO4溶液等体积混合制得氢氧化铜浊液,用于检验醛基 |
| D、不慎将苯酚溶液沾到皮肤上,立即用NaOH溶液清洗 |
可逆反应 2A (气)+3B (气)?2C (气)+D(气),在四种不同条件下反应速率最快的是( )
| A、VA=0.5mol/(L?min) |
| B、VB=0.6mol/(L?min) |
| C、VC=0.35mol/(L?min) |
| D、VD=0.4mol/(L?min) |
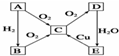 已知,A为空气中含量最多的单质.根据如图转化关系,回答下列问题:
已知,A为空气中含量最多的单质.根据如图转化关系,回答下列问题: