题目内容
用铁片与50mL1mol/L的硫酸反应制取H2时,下列措施不能使氢气生成速率加大的是( )
| A、对该反应体系加热 |
| B、滴加几滴浓硫酸 |
| C、加入少量CH3COONa固体 |
| D、不用铁片,改用铁粉 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:加快生成氢气的速率,可增大浓度,升高温度,增大固体的表面积以及形成原电池反应,以此解答.
解答:
解:A.加热,增大活化分子的百分数,反应速率增大,故A不选;
B.滴加几滴浓硫酸,浓度增大,反应速率增大,故B不选;
C.加入少量CH3COONa固体,氢离子浓度降低,反应速率减小,故C选;
D.不用铁片,改用铁粉,固体表面积增大,反应速率增大,故D不选.
故选C.
B.滴加几滴浓硫酸,浓度增大,反应速率增大,故B不选;
C.加入少量CH3COONa固体,氢离子浓度降低,反应速率减小,故C选;
D.不用铁片,改用铁粉,固体表面积增大,反应速率增大,故D不选.
故选C.
点评:本题考查化学反应速率的影响因素,侧重于基本概念的理解和应用,为高考常见题型和高频考点,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
工业酒精中常含有甲醇,甲醇有剧毒,不能食用,其分子结构可能如图所示的模型表示.下列有关甲醇的叙述中,错误的是( )
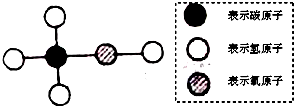

| A、甲醇的化学式为CH4O |
| B、甲醇的相对分子质量为32 |
| C、甲醇中C、H、O三种元素的质量比为1:4:1 |
| D、甲醇中氧元素的质量分数为50% |
现有两种高聚物A、B,已知A能溶于氯仿等有机溶剂,并加热到一定条件下熔融成粘稠的液体,B不溶于任何溶剂,加热不会变软或熔融,则下列叙述中一定不正确的是( )
| A、高聚物A可能具有弹性,B可能没有弹性 |
| B、高聚物A可能是线型高分子材料 |
| C、高聚物A一定是体型高分子材料 |
| D、高聚物B可能是体型高分子材料 |
在一个固定容积的密闭容器中,加入a molA、b molB,发生aA(g)+bB(g)?pC(g),且a+b≠p,则处于平衡状态的标志是( )
| A、c(A)=c(B)=c(C) |
| B、单位时间消耗a molA同时消耗b molB |
| C、混合气体的压强保持不变 |
| D、混合气体的密度保持不变 |
根据下列反应,判断M、N、P的还原性由强到弱的顺序( )
①NCl2+P═N+PCI2
②2MCl3+3N═2M+3NCl2.
①NCl2+P═N+PCI2
②2MCl3+3N═2M+3NCl2.
| A、M>N>P |
| B、P>N>M |
| C、P>M>N |
| D、N>M>P |
设nA为阿伏加德罗常数的值,下列说法正确的是(相对原子质量:C-l2 H-1)( )
| A、2.24L NO2含有0.2nA个氧原子 |
| B、常温常压下,C2H4和C3H6组成的28g混合气体中含4NA个氢原子 |
| C、1 molC2H6分子中含有7NA个极性键 |
| D、常温下pH=13的NaOH溶液中含有的0.1 NA个OH- |
短周期元素X、Y、Z在元素周期表中的位置如图所示.下列说法正确的是( )
| X | ||
| Y | Z |
| A、原子半径的大小为:Z>Y>X |
| B、若X的一种单质为原子晶体,则含Y元素的盐溶液一定呈酸性 |
| C、若Y可作半导体材料,则X、Z的单质均为分子晶体 |
| D、若Y与Z的核电荷数之和为X的4倍,则X、Z各自形成的氢化物熔沸点:X<Z |
Fe3+和Cu2+能够在滤纸上彼此分离开的原因是( )
| A、饱和氯化铁和硫酸铜已经分层 |
| B、阳光照射使Fe3+和Cu2+能彼此分开 |
| C、滤纸对Fe3+和Cu2+的吸附力不同 |
| D、Fe3+和Cu2+在流动相溶剂中的溶解能力,扩散速度不同 |