题目内容
下列说法正确的是( )
| A、在100℃、101 kPa条件下,液态水的气化热为40.69 kJ?mol-1,则H20(g)?H2O(1)的△H=40.6kJ?mol-1 | ||||||||||
| B、已知MgCO3的Kap=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.82×10-6 | ||||||||||
C、已知:
 的△H为-384kJ?mol-1 的△H为-384kJ?mol-1 | ||||||||||
| D、常温下,在0.10mol?L-1的NH3?H2O溶液中加入少量NH4Cl晶体,能使NH3?H2O的电离程度降低,溶液的pH减小 |
考点:反应热和焓变,难溶电解质的溶解平衡及沉淀转化的本质
专题:基本概念与基本理论
分析:A.H2O(g)?H2O(l) 放热,△H应小于0;
B.温度不同,Ksp不同,且在不同的溶液中,c(Mg2+)、c(CO32-)不一定相同;
C.甲苯中不存在C=C键,根据表中数据无法计算;
D.NH3?H2O为弱电解质,存在电离平衡;
B.温度不同,Ksp不同,且在不同的溶液中,c(Mg2+)、c(CO32-)不一定相同;
C.甲苯中不存在C=C键,根据表中数据无法计算;
D.NH3?H2O为弱电解质,存在电离平衡;
解答:
解:A.液态水的气化热为40.69kJ?mol-1,则H2O(g)?H2O(l) 的△H=-40.69 kJ?mol-1,故A错误;
B.温度不同,Ksp不同,且在不同的溶液中,c(Mg2+)、c(CO32-)不一定相同,如在碳酸钠溶液中c(Mg2+)<c(CO32-),故B错误;
C.甲苯中不存在C=C键,根据表中数据无法计算,故C错误;
D.NH3?H2O为弱电解质,存在电离平衡,为NH3?H2O?NH4++OH-,加入少量NH4Cl晶体,c(NH4+)浓度增大,平衡向逆反应方向移动,能使NH3?H2O的电离度降低,溶液的pH减小,故D正确;
故选D.
B.温度不同,Ksp不同,且在不同的溶液中,c(Mg2+)、c(CO32-)不一定相同,如在碳酸钠溶液中c(Mg2+)<c(CO32-),故B错误;
C.甲苯中不存在C=C键,根据表中数据无法计算,故C错误;
D.NH3?H2O为弱电解质,存在电离平衡,为NH3?H2O?NH4++OH-,加入少量NH4Cl晶体,c(NH4+)浓度增大,平衡向逆反应方向移动,能使NH3?H2O的电离度降低,溶液的pH减小,故D正确;
故选D.
点评:本题综合考查化学反应与能量的变化,为高考高频考点,侧重于学生的分析能力和基本理论的综合应用的考查,易错点为D,注意苯环不含C=C的特点,难度不大.

练习册系列答案
相关题目
用下列装置进行相应实验,能达到实验目的是( )
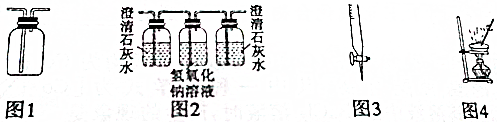

| A、用图1所示装置可以收集H2、NH3、CO2、NO2等气体 |
| B、用图2所示装置可以验证SO2气体中含有CO2气体 |
| C、用图3所示仪器可以量取Na2CO3溶液 |
| D、用图4所示装置可以进行硫酸铜晶体中结晶水含量的测定 |
下列醇不能发生消去反应的是( )
① ②
② ③CH3OH ④
③CH3OH ④
①
 ②
② ③CH3OH ④
③CH3OH ④
| A、①② | B、②④ | C、①③ | D、③④ |
下列说法正确的是( )
| A、凡是含有羟基的有机物一定是醇 |
| B、凡能发生银镜反应的有机物一定是醛 |
| C、当羟基与苯环直接相连构成的有机物一定是酚 |
| D、在氧气中燃烧只生成CO2和H2O的物质一定是烃 |
将11.2g的Mg-Cu混合物完全溶解于足量的硝酸中收集反应产生的X气体,再向所得溶液中加入足量的NaOH溶液,产生21.4g沉淀.推断气体X的成分可能是( )
| A、0.3mo1NO2 |
| B、0.2mo1NO2和0.1mo1N2O4 |
| C、0.1mol NO、0.2mol NO2和0.05mol N2O4 |
| D、0.6mo1NO |
下列说法正确的是( )
| A、同族元素的氧化物可能形成不同的晶体类型 |
| B、符合CnH2n一定是烯烃 |
| C、Na2O2中阳离子与阴离子数目比1:1 |
| D、氯化钠晶胞中Na+的配位数为8 |

 金属铁及其化合物在合金材料以及催化剂等方面应用广泛.请回答下列问题:
金属铁及其化合物在合金材料以及催化剂等方面应用广泛.请回答下列问题: