题目内容
(14+2分)已知元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大。X基态原子的核外电子分布在3个能级,且各能级电子数相等,Z是地壳中含量最多的元素,W是电负性最大的元素,元素Q的核电荷数等于Y、W原子的最外层电子数之和。另有R元素位于元素周期表第4周期第Ⅷ族,外围电子层有2个未成对电子。请回答下列问题。
(1)微粒 的中心原子杂化类型为 ,化合物YW3的空间构型为 。
的中心原子杂化类型为 ,化合物YW3的空间构型为 。
(2)R基态原子的电子排布式为 。
(3)一种新型超导晶体的晶胞如图所示,则该晶体的化学式为 ,
其中一个Q原子紧邻 个R原子。

(4)R的氢氧化物能溶于含XY-离子的溶液生成一种配离子[R(XY)4]2-,该反应的离子方程式是 。弱酸HXY分子中存在的σ键与π键的数目之比为 。
(1)sp2 三角锥形 (2)1s22s22p63s23p63d84s2 或[Ar]3d84s2 (3)MgNi3C 12
(4)Ni(OH)2+4CN-=[Ni(CN)4]2-+2OH- 1:1
【解析】
试题分析:元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大。X基态原子的核外电子分布在3个能级,且各能级电子数相等,因此X是碳元素;Z是地壳中含量最多的元素,则Z是氧元素,所以是氮元素;W是电负性最大的元素,则W是氟元素;元素Q的核电荷数等于Y、W原子的最外层电子数之和,即Q的原子序数是5+7=12,则Q是Mg。R元素位于元素周期表第4周期第Ⅷ族,外围电子层有2个未成对电子,则R是Ni元素。
(1)微粒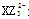 是碳酸根离子,碳原子的价层电子对数=3,且无孤对电子,所以中心原子杂化类型为sp2杂化;化合物YW3是NF3,氮原子的价层电子对数=3+
是碳酸根离子,碳原子的价层电子对数=3,且无孤对电子,所以中心原子杂化类型为sp2杂化;化合物YW3是NF3,氮原子的价层电子对数=3+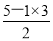 =4,含有一对孤对电子,所以空间构型为三角锥形。
=4,含有一对孤对电子,所以空间构型为三角锥形。
(2)根据核外电子排布规律可知基态Ni原子的电子排布式为1s22s22p63s23p63d84s2 或[Ar]3d84s2。
(3)根据晶胞的结构可知,晶胞中含有一个碳原子,Mg原子个数=8×1/8=1个,Ni原子个数=6×1/2=3个,则该晶体的化学式为MgNi3C,镁原子位于顶点处,镍位于面心处,则其中一个Q原子紧邻12个R原子。
(4)Ni的氢氧化物能溶于含CN-离子的溶液生成一种配离子[R(XY)4]2-,该反应的离子方程式是Ni(OH)2+4CN-=[Ni(CN)4]2-+2OH-;弱酸HXY分子的结构式为H-C≡N,由于单键都是σ键,而三键是由1个σ键和2个π键构成,则分子中存在的σ键与π键的数目之比为1:1。
考点:考查元素推断、核外电子排布、杂化轨道、空间构型、共价键以及晶胞结构等

 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案下列有关物质性质、结构的表述均正确,且存在因果关系的是
表述Ⅰ | 表述Ⅱ | |
A | 在形成化合物时,同一主族元素的化合价相同 | 同一主族元素原子的最外层电子数相同 |
B | 在水中,NaCl的溶解度比I2的溶解度大 | NaCl晶体中C1—与Na+间的作用力大于碘晶体中分子间的作用力 |
C | P4O10、C6H12O6溶于水后均不导电 | P4O10、C6H12O6均属于共价化合物 |
D | 通常条件下,CH4分子比PbH4分子稳定性高 | Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |


 pC(g)的平衡常数为K,下列对K的说法正确的是
pC(g)的平衡常数为K,下列对K的说法正确的是