题目内容
下列离子方程式正确的是( )
| A、二氧化硅与强碱溶液反应:SiO2+2OH-=SiO32-+H2O |
| B、将氯气通入水中:Cl2+H2O=2H++Cl-+ClO- |
| C、金属钠与水反应:Na+H2O=Na++OH-+H2↑ |
| D、少量的金属锌加入到FeCl3溶液中:2Fe3++3Zn=2Fe+3Zn2+ |
考点:离子方程式的书写
专题:
分析:A.二氧化硅与氢氧化钠反应生成硅酸钠和水;
B.次氯酸为弱电解质,应保留化学式;
C.原子个数不守恒;
D.金属锌少量,三价铁离子与锌离子反应生成二价铁离子和锌离子.
B.次氯酸为弱电解质,应保留化学式;
C.原子个数不守恒;
D.金属锌少量,三价铁离子与锌离子反应生成二价铁离子和锌离子.
解答:
解:A.二氧化硅与氢氧化钠反应生成硅酸钠和水,离子方程式为:SiO2+2OH-=SiO32-+H2O,故A正确;
B.将氯气通入水中,离子方程式:Cl2+H2O=H++Cl-+HClO,故B错误;
C.金属钠与水反应,离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故C错误;
D.少量的金属锌加入到FeCl3溶液中,离子方程式:2Fe3++Zn=2Fe2++Zn2+,故D错误;
故选:A.
B.将氯气通入水中,离子方程式:Cl2+H2O=H++Cl-+HClO,故B错误;
C.金属钠与水反应,离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故C错误;
D.少量的金属锌加入到FeCl3溶液中,离子方程式:2Fe3++Zn=2Fe2++Zn2+,故D错误;
故选:A.
点评:本题考查了离子方程式的书写,题目难度不大,明确发生的化学反应即可解答,注意离子方程式应遵循电荷守恒、原子个数守恒.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
下列叙述中正确的是?( )
| A、构成原电池正极和负极的材料必须是两种金属? |
| B、由Cu、Zn作电极与CuSO4溶液组成的原电池中,Cu上产生气泡? |
| C、氢氧燃料电池中,把H2通入正极,此极发生氧化反应 |
| D、在锌铜原电池外电路中,电子由锌流向铜 |
在100mL(NH4)2SO4和Al2(SO4)3的混合溶液中,加入足量的BaCl2的溶液,生成9.32g沉淀,再加入足量NaOH溶液并加热,生成NH3448mL(标准状况),则原溶液中Al3+的浓度为( )
| A、0.10mol/L |
| B、0.20mol/L |
| C、0.30mol/L |
| D、0.40mol/L |
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4LH2O含有的分子数为1 NA |
| B、32克氧气所含原子数目为4 NA |
| C、1 mol Ca变成Ca2+时失去的电子数为2NA |
| D、1 L 0.1mol?L-1 Na2SO4溶液中有0.1 NA个Na+ |
设NA为阿佛加德罗常数,下列说法正确的是( )
①32g O2和O3混合气体中含有原子数为2NA
②1molFe被完全氧化生成Fe2O3,失去个3NA电子
③1L 2mol/L的氯化镁溶液中含氯离子为4NA
④标准状况下22.4LH2O中分子数为NA
⑤78gNa2O2含有阴、阳离子总数是4NA.
①32g O2和O3混合气体中含有原子数为2NA
②1molFe被完全氧化生成Fe2O3,失去个3NA电子
③1L 2mol/L的氯化镁溶液中含氯离子为4NA
④标准状况下22.4LH2O中分子数为NA
⑤78gNa2O2含有阴、阳离子总数是4NA.
| A、①②③ | B、③④ |
| C、①③④ | D、①②③⑤ |
下列有机化学方程式书写正确的是( )
A、CH2=CH2+HCl
| ||
B、蔗糖C12H22O11+H2O
| ||
C、2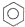 +Br2 +Br2
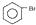 | ||
D、CH4+Cl2
|


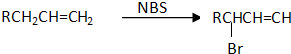
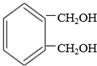 互为同分异构体的结构简式
互为同分异构体的结构简式