题目内容
11.将60℃的硫酸铜饱和溶液100g,冷却到20℃,下列说法正确的是( )| A. | 溶液质量不变 | B. | 溶剂质量发生变化 | ||
| C. | 溶液为饱和溶液,浓度不变 | D. | 有晶体析出,溶剂质量不变 |
分析 饱和溶液:在一定温度、一定量的溶剂中,溶质不能继续被溶解的溶液,据此解答即可.
解答 解:硫酸铜结晶析出的产物是五水硫酸铜,即带有5个结晶水;A.此变化溶液冷却,有晶体析出,溶液质量减少,故A错误;B.此溶液析出五水硫酸铜晶体,溶质和溶剂均发生变化,故B正确;C.此时溶液仍为饱和溶液,浓度减少,故C错误;D.此时析出的晶体是五水硫酸铜,溶剂质量减少,故D错误,故选B.
点评 本题主要考查的是饱和溶液的概念以及硫酸铜晶体析出的特殊性,本题有一定的难度.

练习册系列答案
相关题目
1.某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1-2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.
供选用的试剂:a.酚酞试液;b.CCl4; c.无水酒精;d. KSCN溶液.
请你在下表中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
(4)结论
氧化性:Br2>Fe3+.故在足量的稀氯化亚铁溶液中,加入1-2滴溴水,溶液呈黄色所发生的离子反应方程式为2Fe2++Br2=2Fe3++2Br-.
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是Fe2+(填离子的化学式).
②在100mL FeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量的浓度为1mol/L.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.
供选用的试剂:a.酚酞试液;b.CCl4; c.无水酒精;d. KSCN溶液.
请你在下表中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
氧化性:Br2>Fe3+.故在足量的稀氯化亚铁溶液中,加入1-2滴溴水,溶液呈黄色所发生的离子反应方程式为2Fe2++Br2=2Fe3++2Br-.
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是Fe2+(填离子的化学式).
②在100mL FeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量的浓度为1mol/L.
2.下列实验装置能达到实验目的是( )
| A. |  实验室制取并收集Cl2 | B. |  检验乙烯中是否含有SO2 | ||
| C. |  分离Br2和H20的混合物 | D. |  验证氧化性Cl>I2 |
6.2006年11月23日中科院网报道,纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和作为药物载体用于疾病的治疗.其制备过程如图,下列叙述合理 的是( )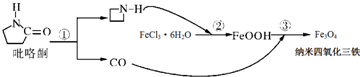

| A. | Fe3O4可以表示为FeO•Fe2O3,属于混合物 | |
| B. | 在反应②中FeCl3•6H2O被环丙胺(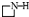 )还原为FeOOH )还原为FeOOH | |
| C. | 纳米四氧化三铁材料为胶体 | |
| D. | 反应③的化学方程式是:6FeOOH+CO═2Fe3O4+3H2O+CO2 |
3.氢化钠可以作为生氢剂(其中NaH中氢元素为-1价),反应方程式如下:NaH+H2O═NaOH+H2↑,则下列说法正确的是( )
| A. | 反应是置换反应,反应中有2个电子转移 | |
| B. | 反应是复分解反应 | |
| C. | 反应是氧化还原反应,反应中电子转移数为1 | |
| D. | 反应的离子方程式为H-+H+═H2↑ |
