题目内容
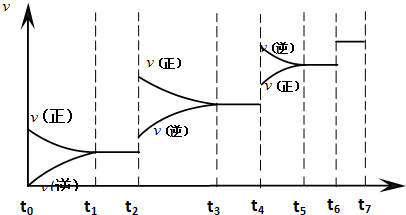
2.在容积不变的密闭容器中进行如下反应:N2+3H2?2NH3,若将平衡体系中各物质的浓度都增加到原来的2倍,则下列说法错误的是( )| A. | 平衡正向移动 | B. | 平衡逆向移动 | ||
| C. | 正逆反应速率都增大 | D. | NH3的质量分数增加 |
分析 若将平衡体系中各物质的浓度都增加到原来的2倍,则应缩小体积,增大压强,则平衡向正反应方向移动,以此来解答.
解答 解:反应前气体化学计量数之和大于反应后气体的化学计量数之和,若将平衡体系中各物质的浓度都增加到原来的2倍,则应缩小体积,增大压强,则平衡向正反应方向移动,
A.由上述分析可知,平衡正向移动,故A正确;
B.平衡正向移动,而不是逆向移动,故B错误;
C.压强增大,正逆反应速率均增大,故C正确;
D.平衡正向移动,所以NH3的质量分数将增加,故D正确;
故选B.
点评 本题考查化学平衡的影响因素,题目难度不大,本题注意浓度、压强对化学平衡的影响,把握浓度的变化转化为压强问题是解答的关键.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
12.下列说法不正确的是( )
| A. | 工业制硫酸时用到的主要设备有沸腾炉、接触室、吸收塔 | |
| B. | 可用KSCN溶液检验某溶液中是否存在Fe3+ | |
| C. | 相同条件下同体积同浓度的盐酸分别与等质量的碳酸钠、碳酸氢钠固体反应,后者速率快 | |
| D. | 铝粉可与氧化镁在高温下发生铝热反应 |
13.下列各组离子在水溶液中不是因为水解而不能大量共存的是( )
| A. | K+、Ca2+、HCO3-、Br- | B. | SO32-、Al(OH)4-、K+、Al3+ | ||
| C. | Fe3+、Na+、NO3-、CO32- | D. | NH4+、Na+、SiO32-、I- | ||
| E. | Ca2+、Na+、NO3-、PO43- |
10.某学生做完实验后,采用下列方法清洗所用仪器:
①用稀硝酸清洗做过银镜反应后的试管
②用酒精清洗做过碘升华的烧杯
③用浓盐酸清洗做过高锰酸钾分解实验的试管
④用盐酸清洗长期存放三氯化铁溶液的试剂瓶
⑤用氢氧化钠溶液清洗沾有硫磺的试管
下列对以上操作的判断.正确的是( )
①用稀硝酸清洗做过银镜反应后的试管
②用酒精清洗做过碘升华的烧杯
③用浓盐酸清洗做过高锰酸钾分解实验的试管
④用盐酸清洗长期存放三氯化铁溶液的试剂瓶
⑤用氢氧化钠溶液清洗沾有硫磺的试管
下列对以上操作的判断.正确的是( )
| A. | 除④外都对 | B. | 除⑤外都对 | C. | ④⑤不对 | D. | 全都正确 |
17.下列各组离子,在指定环境中一定能大量共存的是( )
| A. | 在能使pH试纸变红的溶液中:Fe2+、Na+、Cl-、NO3- | |
| B. | 在含有S2-离子的溶液中:NH4+、K+、Cl-、SO42- | |
| C. | 在由水电离出的c(H+)=10-12mol•L-1的溶液中Na+、Ba2+、Cl- | |
| D. | 在无色溶液中:NH4+、Mg2+、SO42-、SiO32- |