题目内容
过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是
| A.升高温度 | B.加入适量的水 |
| C.加入少量CuSO4溶液 | D.加入浓度较大的盐酸 |
B
解析试题分析:根据反应的实质为Zn+2H+═Zn2++H2↑可知,为了减缓反应速率,但又不影响生成氢气的总量,则减小氢离子的浓度但不能改变氢离子的物质的量即可,以此来解答。
A、升高反应体系温度,反应速率增大,不影响生成氢气的总量,故A错误;
B、加水稀释氢离子的浓度减小,减缓反应速率,但又不影响生成氢气的总量,故B正确;
C、加入少量CuSO4溶液,锌与硫酸铜反应置换出铜,形成原电池,反应速率加快,因为是过量的锌粉,所以不影响生成的氢气总量,故B错误;
D、加浓盐酸,氢离子的浓度增大,加快反应速率,但氢离子的物质的量增多,会影响生成氢气的总量,故D错误,答案选B。
考点:考查影响化学反应速率的因素
点评:该题是高考中的常见考点,属于中等难度的试题。试题针对性强,贴近高考,侧重对稀释分析、归纳或总结问题的能力的培养,有利于培养学生的逻辑推理能力和灵活应变能力。明确温度、浓度、接触面积对反应速率的影响即可解答,选项C为学生解答中的难点。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案下列说法正确的是
| A.除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤 |
| B.某温度时,纯水中c(H+)=2×10-7mol·L-1,则c(OH-)=5×10-8mol·L-1 |
C.N2(g)+3H2(g) 2NH3(g),其他条件不变,增大压强,v(正)增大而v(逆)减小 2NH3(g),其他条件不变,增大压强,v(正)增大而v(逆)减小 |
D.Na2CO3溶液中存在平衡:CO32-+H2O HCO3-+OH一,升高温度溶液碱性增强 HCO3-+OH一,升高温度溶液碱性增强 |
在一固定容积的密闭容器中进行如下反应:2SO (g)+O
(g)+O (g)
(g) 2SO
2SO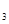 (g),已知反应进行到10秒时,SO
(g),已知反应进行到10秒时,SO 、O
、O 、SO
、SO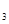 的物质的量分别为0.2 mol、0.1 mol、0.2 mol,则下列说法正确的是
的物质的量分别为0.2 mol、0.1 mol、0.2 mol,则下列说法正确的是
A.10秒时,用O 表示该反应的平均反应速率为0.01 mol/(L·s) 表示该反应的平均反应速率为0.01 mol/(L·s) |
B.当反应达平衡时,SO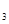 的物质的量可能为0.4 mol 的物质的量可能为0.4 mol |
C.当SO 和O 和O 的生成速率之比为2:1时,达到该反应限度 的生成速率之比为2:1时,达到该反应限度 |
D.向容器内充人SO ,可以提高反应速率 ,可以提高反应速率 |
把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由图表示。在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl 的浓度。影响反应速率的因素是
的浓度。影响反应速率的因素是 
| A.①④ | B.③④ |
| C.①②③ | D.②③ |
某温度下,浓度都为1 mol·L-1的两种气体X2和Y2在密闭容器中反应生成气体Z,经过一段时间后c(X2)为0.4 mol·L-1, c (Y2)为0.8 mol·L-1, c (Z)为0.4 mol·L-1,则反应为( )
A.X2+2Y2 2XY2 2XY2 | B.2X2+Y2 2X2Y 2X2Y |
C.3X2+Y2 2X3Y 2X3Y | D.X2+3Y2 2XY3 2XY3 |
硫酸是一种重要的化工产品,硫酸的消耗量常被视为一个国家工业发达水平的一种标志。目前主要生产方法是“接触法”,有关2SO2+O2 2SO3的说法中,不正确的是
2SO3的说法中,不正确的是
| A.该反应为可逆反应,故在一定条件下SO2和O2不可能全部转化为SO3 |
| B.达到平衡后,反应就停止了,故正、逆反应速率相等且均为零 |
| C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻之后,正、逆反应速率相等 |
| D.平衡时SO2、O2、SO3的分子数之比不再改变 |
下列说法不正确的是
| A.原电池负极被氧化 |
| B.任何化学反应都能设计成原电池 |
| C.化学反应的速率和限度均可通过改变化学反应条件而改变 |
| D.化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变 |
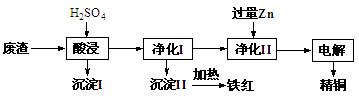
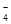 +10H+=5Fe3++Mn2++5H2O)
+10H+=5Fe3++Mn2++5H2O)