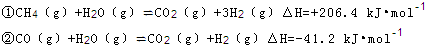题目内容
工业上利用某工厂的废渣(主要含CuO70%、MgFe2O420%,还含有少量FeO、NiO等氧化物)制取精铜和颜料铁红。流程如图所示。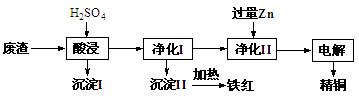
回答下列问题:
(1)净化Ⅰ操作分为两步:
第一步是将溶液中少量的Fe2+氧化;
第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下用H2O2氧化Fe2+反应的离子方程式: 。
②25 ℃时,pH=3的溶液中,c(Fe3+)=___________mol·L-1(已知25 ℃,Ksp[Fe( OH)3]=4.0×10-38)。
③净化Ⅰ中第二步可选用CuO实现转化,用化学平衡移动原理说明其原因:
。
(2)用净化II所得的金属为电极进行电解得精铜,请写出阴极所发生的电极反应式:______________________________。
(3)为准确测定酸浸液中Fe2+的物质的量浓度以确定H2O2的用量,测定步骤如下:
①取出25.00mL酸浸液,配制成250.0mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,将0.2000mol/LKMnO4溶液装入
(填仪器名称),进行滴定,记录数据,重复滴定3次,平均消耗KMnO4溶液V mL。(反应离子方程式:5Fe2++MnO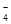 +10H+=5Fe3++Mn2++5H2O)
+10H+=5Fe3++Mn2++5H2O)
③计算酸浸液中Fe2+的物质的量浓度= mol/L (只列出算式,不做运算)。
(1) ① H2O2+2Fe2++2H+===2Fe3++2H2O(3分)
②4.0×10-5 (3分,不考虑有效数字)
③Fe3+在溶液中存在水解平衡(1分),CuO结合Fe3+水解产生的H+,使溶液中H+浓度降低(1分),促进Fe3+的水解平衡向生成Fe(OH)3方向移动(1分),Fe3+转化为Fe(OH)3沉淀。(合理即给分)
(2)Cu2+ +2e-= Cu (2分)
(3)②酸式滴定管 (2分)
③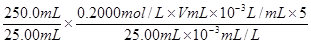 或0.4000 V (2分,单位、有效数字有错误合扣1分,代入数值不带单位不扣分,化简也给分。)
或0.4000 V (2分,单位、有效数字有错误合扣1分,代入数值不带单位不扣分,化简也给分。)
解析试题分析:双氧水具有氧化性,因此可以把二价的铁氧化成为三价的铁即
H2O2+2Fe2++2H+===2Fe3++2H2O。又溶解度常数可得出铁离子的浓度乘以氢氧根离子浓度的三次方等于4.0×10-38而氢氧根离子浓度由离子积常数求得出为10-11,所以铁离子的浓度为4.0×10-5。净化Ⅰ中第二步可选用CuO实现转化主要是由于e3+在溶液中存在水解平衡,CuO结合Fe3+水解产生的H+,使溶液中H+浓度降低,促进Fe3+的水解平衡向生成Fe(OH)3方向移动,Fe3+转化为Fe(OH)3沉淀。在精炼铜时,阴极是纯铜,阳极是粗铜,电解质溶液一般选择硫酸铜,因此阴极的电极反应式为Cu2+ +2e-= Cu。高锰酸钾显酸性,因此用酸式滴定管来测量。再由题目提供的反应方程式,可知亚铁离子与锰酸根离子的比例关系是5;1的关系,然后列方程就可以求得出Fe2+的物质的量浓度为0.4000 V
考点:考查溶解平衡以及精炼铜的相关知识点

过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是
| A.升高温度 | B.加入适量的水 |
| C.加入少量CuSO4溶液 | D.加入浓度较大的盐酸 |
对已达化学平衡的反应2X(g)+Y(g) 2Z(g),减小压强时,对反应产生的影响是( )
2Z(g),减小压强时,对反应产生的影响是( )
| A.逆反应速率增大正反应速率减小,平衡向逆反应方向移动 |
| B.逆反应速率减小正反应速率增大,平衡向正反应方向移动 |
| C.正、逆反应速率都减小,平衡向逆反应方向移动 |
| D.正、逆反应速率都增大,平衡向正反应方向移动 |
下列反应中不属于可逆反应的是
A.   |
B.   |
C.  HCl + HClO HCl + HClO |
D.   |
(8分)化学反应的快慢和限度对人类生产生活有重要的意义。
(1)请将影响表中“实例”反应速率的“条件”仿照示例填在空格横线上。
| 实例 | 影响条件 |
| ①食物放在冰箱里能延长保质期 | 温度(示例) |
| ②实验室将块状药品研细,再进行反应 | ____________ |
| ③用H2O2分解制O2时,加入MnO2 | ____________ |
| ④工业制硫酸催化氧化SO2制取SO3时,通入过量的空气 | ____________ |

①写出该反应的化学方程式__________。
②从反应开始到10 s,用Z表示的反应速率为__________mol/(L·s)。
③该反应的化学平衡常数为__________(结果保留整数)。
④当反应进行到15 s时,向密闭容器中通入氩气,此时用Z表示的反应速率__________(填“小于”或“等于”或“大于”)10 s时用Z表示的反应速率。
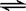 3C+4D中,表示该反应速率最快的是( )
3C+4D中,表示该反应速率最快的是( ) xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
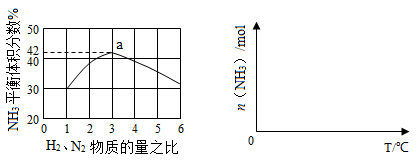
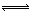 2NH3(g) ?H=—92.4kJ?mol?1
2NH3(g) ?H=—92.4kJ?mol?1