题目内容
过量的铁粉与100 mL 0.1 mol/L的稀盐酸反应,反应速率太快。为了降低此反应速率而不改变产生H2的量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入过量浓硫酸 ④加少量的CH3COONa固体 ⑤加NaCl溶液
⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)⑧改用10 mL 1 mol/L的盐酸
| A.①⑥⑦ | B.①④⑤ | C.③⑦⑧ | D.③⑥⑦⑧ |
B
解析试题分析:产生氢气的量不变,则必须保证氢离子的物质的量不变;要降低反应速率,应降低盐酸的浓度或降低温度等。
①加水,稀释了盐酸的浓度,故反应速率变慢,且生成的氢气不变;
②加氢氧化钠,与盐酸反应,减少了盐酸的浓度,故反应速率变慢,但生成的氢气也减少;
③加浓盐酸,反应速率加快;
④加醋酸钠固体与盐酸反应生成弱酸醋酸,故反应速率减慢,且生成的氢气不变;
⑤加氯化钠溶液,相当于稀释盐酸浓度,故反应速率变慢,且生成的氢气不变;
⑥滴加硫酸铜溶液,铁把铜置换出来,形成原电池,故反应速率加快;
⑦升高温度,反应速率加快;
⑧改用浓度大的盐酸,反应速率加快,答案选B。
考点:考查外界条件对反应速率的影响
点评:该题是高考中的常见题型,试题综合性强,对学生的要求较高,有利于调动学生的学习兴趣,增强学生的学习自信心。该题的关键是明确外界条件是如何影响反应速率的,另外审题时要注意:降低反应速率和不改变氢气的量。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案为了探索外界条件对反应:aX(g)+bY(g) cZ(g)的影响,将X和Y以物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。 下列判断正确的是
cZ(g)的影响,将X和Y以物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。 下列判断正确的是
| A.△H<0,a+b>c |
| B.△H>0,a+b<c |
| C.△H>0,a+b>c |
| D.△H<0,a+b<c |
过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是
| A.升高温度 | B.加入适量的水 |
| C.加入少量CuSO4溶液 | D.加入浓度较大的盐酸 |
决定化学反应速率的主要因素是
| A.反应物的性质 | B.反应温度 |
| C.反应物的浓度 | D.使用催化剂 |
已知反应I2(g)+H2(g)  2HI(g) ΔH<0,下列说法正确的是( )
2HI(g) ΔH<0,下列说法正确的是( )
| A.降低温度,正向反应速率减小倍数大于逆向反应速率减小倍数 |
| B.升高温度将缩短达到平衡的时间 |
| C.达到平衡后,保持温度和容积不变,充入氩气,正、逆反应速率同等倍数增大 |
| D.达到平衡后,保持温度和压强不变,充入氩气,HI的质量将减小 |
某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:
3A(g)+2B(g) 4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A.该反应的化学平衡常数表达式是K= |
| B.此时,B的平衡转化率是35% |
| C.增大该体系的压强,平衡向右移动,化学平衡常数增大 |
| D.增加C,B的平衡转化率不变 |
对已达化学平衡的反应2X(g)+Y(g) 2Z(g),减小压强时,对反应产生的影响是( )
2Z(g),减小压强时,对反应产生的影响是( )
| A.逆反应速率增大正反应速率减小,平衡向逆反应方向移动 |
| B.逆反应速率减小正反应速率增大,平衡向正反应方向移动 |
| C.正、逆反应速率都减小,平衡向逆反应方向移动 |
| D.正、逆反应速率都增大,平衡向正反应方向移动 |
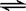 3C+4D中,表示该反应速率最快的是( )
3C+4D中,表示该反应速率最快的是( )