题目内容
某同学设计了如图装置用于制取SO2和验证SO2的性质.分液漏斗内装75%的浓硫酸,锥形瓶内装固体Na2SO3.试回答以下问题:
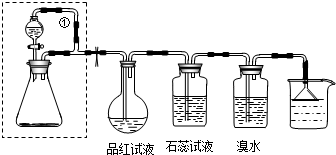
(1)锥形瓶内发生的反应的化学方程式为: .
(2)实验过程中,品红试液的颜色变为 色;石蕊试液的颜色变为 色.实验后加热烧瓶,品红试液的颜色变为 色.
(3)溴水与SO2反应的离子方程式为: .
(4)导管①的作用是: ;倒置漏斗的作用是 .

(1)锥形瓶内发生的反应的化学方程式为:
(2)实验过程中,品红试液的颜色变为
(3)溴水与SO2反应的离子方程式为:
(4)导管①的作用是:
考点:探究二氧化硫与水和品红溶液的反应
专题:实验题
分析:(1)锥形瓶内亚硫酸钠和浓硫酸反应生成硫酸钠和水和二氧化硫,据此书写化学方程式;
(2)二氧化硫可使品红溶液褪色,表现了二氧化硫的漂白性,二氧化硫能使石蕊试液的颜色变为红色体现酸性,加热褪色后的品红溶液,溶液的颜色能复原,所以实验后加热烧瓶品红试液的颜色恢复红色;
(3)二氧化硫具有还原性,能与溴水发生氧化还原反应生成硫酸和氢溴酸;
(4)导管①的作用是平衡分液漏斗和锥形瓶内压强,使液体能够顺利流下,倒置漏斗能防止溶液倒吸.
(2)二氧化硫可使品红溶液褪色,表现了二氧化硫的漂白性,二氧化硫能使石蕊试液的颜色变为红色体现酸性,加热褪色后的品红溶液,溶液的颜色能复原,所以实验后加热烧瓶品红试液的颜色恢复红色;
(3)二氧化硫具有还原性,能与溴水发生氧化还原反应生成硫酸和氢溴酸;
(4)导管①的作用是平衡分液漏斗和锥形瓶内压强,使液体能够顺利流下,倒置漏斗能防止溶液倒吸.
解答:
解:(1)亚硫酸钠(Na2SO3)固体与较浓硫酸(H2SO4)在锥形瓶内反应,生成硫酸钠和水和二氧化硫,化学反应方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)二氧化硫可使品红溶液褪色,表现了二氧化硫的漂白性,所以实验过程中,品红试液的颜色变为无色,二氧化硫和水反应生成亚硫酸,石蕊试液遇酸显红色,二氧化硫漂白不稳定,实验后加热烧瓶,品红试液的颜色恢复红色,
故答案为:无;红;红;
(3)SO2通入溴水中,二氧化硫被氧化剂溴单质氧化为硫酸,反应的化学方程式SO2+Br2+2H2O=H2SO4+2HBr,反应的离子方程式为:SO2+Br2+2H2O═4H++SO42-+2Br-;
故答案为:Br2+SO2+2H2O=4H++2Br-+SO42-;
(4)导管①用橡皮管连接分液漏斗和锥形瓶,能平衡分液漏斗和锥形瓶内压强,使液体能够顺利流下,倒扣的漏斗溶液上升具有缓冲作用,能防止倒吸,防止烧杯内液体倒流入左侧试剂瓶内,
故答案为:平衡分液漏斗和锥形瓶内压强,使液体能够顺利流下;防止烧杯内液体倒流入左侧试剂瓶内.
故答案为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)二氧化硫可使品红溶液褪色,表现了二氧化硫的漂白性,所以实验过程中,品红试液的颜色变为无色,二氧化硫和水反应生成亚硫酸,石蕊试液遇酸显红色,二氧化硫漂白不稳定,实验后加热烧瓶,品红试液的颜色恢复红色,
故答案为:无;红;红;
(3)SO2通入溴水中,二氧化硫被氧化剂溴单质氧化为硫酸,反应的化学方程式SO2+Br2+2H2O=H2SO4+2HBr,反应的离子方程式为:SO2+Br2+2H2O═4H++SO42-+2Br-;
故答案为:Br2+SO2+2H2O=4H++2Br-+SO42-;
(4)导管①用橡皮管连接分液漏斗和锥形瓶,能平衡分液漏斗和锥形瓶内压强,使液体能够顺利流下,倒扣的漏斗溶液上升具有缓冲作用,能防止倒吸,防止烧杯内液体倒流入左侧试剂瓶内,
故答案为:平衡分液漏斗和锥形瓶内压强,使液体能够顺利流下;防止烧杯内液体倒流入左侧试剂瓶内.
点评:本题考查学生对实验原理与装置的理解与评价、常用化学用语书写、离子具检验与实验方案设计、阅读获取信息能力等,掌握二氧化硫酸性氧化物性质、漂白性、还原性等是解题关键,题目难度中等.

练习册系列答案
相关题目
有关有机物的说法正确的是( )
| A、石油分馏可以获得重要的有机化工原料乙烯 |
| B、乙醇、乙酸、乙酸乙酯可用饱和氢氧化钠溶液鉴别 |
| C、乙烷和苯所含的碳碳键不同,但都能发生氧化反应和取代反应 |
| D、糖类、油脂和蛋白质都是人体必需的营养物质,它们的组成元素相同 |
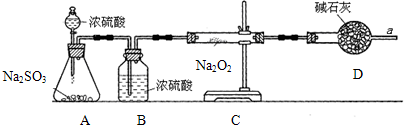
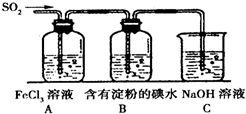 为探究SO2气体的还原性某兴趣小组设计了如装置图:
为探究SO2气体的还原性某兴趣小组设计了如装置图: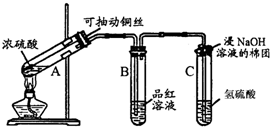
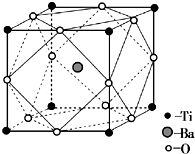 钛被誉为“未来世纪的金属”.试回答下列问题:
钛被誉为“未来世纪的金属”.试回答下列问题: