题目内容
13.标准状况下有三种气体:①6.72L NH3 ②1.204×1023个 H2S ③5.6g CH4,下列关系正确的是( )| A. | 体积大小:③>②>① | B. | 原子数目:③>①>② | C. | 密度大小:②>③>① | D. | 质量大小:②>①>③ |
分析 根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$分别计算出三种物质的量的物质的量,
A.相同条件下气体体积之比等于其物质的量之比;
B.根据各物质的分子组成及物质的量计算出含有原子数目;
C.由ρ=$\frac{M}{{V}_{m}}$可知,相同条件下密度之比等于摩尔质量之比;
D.根据m=nM计算出各物质的质量大小.
解答 解:①6.72L NH3的物质的量为:$\frac{6.72L}{22.4L/mol}$=0.3mol;
②1.204×1023个 H2S 的物质的量为:$\frac{1.204×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.2mol;
③5.6g CH4的物质的量为:$\frac{5.6g}{16g/mol}$=0.35mol,
A.根据V=nVm知,相同条件下体积之比等于物质的量之比,故体积③>①>②,故A错误;
B.原子的物质的量分别为0.3mol×4、0.2mol×3、0.35mol×5,则原子数目:③>①>②,故B正确;
C.由ρ=$\frac{M}{{V}_{m}}$可知,相同条件下,密度之比等于摩尔质量之比,故密度②>①>③,故C错误;
D.根据m=nM知,氨气的质量为0.3mol×17g/mol=5.1g,H2S的质量为0.2mol×34g/mol=3.8g,则质量大小:②>③>①,故D错误;
故选B.
点评 本题考查了阿伏伽德罗定律及其推论,明确物质的量的基本公式中各个物理量之间的关系是解本题关键,灵活运用基本公式分析解答即可,题目难度中等.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
3.X、Y、Z、W 均为短周期元素,原子序数依次增大.Y 原子的 M 电子层有 1 个 电子,同周期的简单离子的半径中 Z 最小.W 与 X 同主族,其最高化合价是最低 负化合价绝对值的 3 倍.下列说法正确的是( )
| A. | 最高价氧化物水化物的碱性:Y<Z | B. | 简单气态氢化物的热稳定性:X<W | ||
| C. | 简单气态氢化物的沸点:X<W | D. | 简单离子的还原性:X<W |
8.下列说法正确的是( )
| A. | 化学变化中一定发生物理变化 | |
| B. | 蓄电池充电时,电能转变成化学能 | |
| C. | 人类利用的能量都是通过化学反应获得的 | |
| D. | 有颜色改变的变化一定是化学变化 |
18.下列反应达到平衡后,保持温度和容器体积不变,再加入一定量的反应物.再次达到平衡后反应物的转化率会增大的是( )
| A. | 2NO2(g)?N2O4(g) | B. | 2HI(g)?H2(g)+I2(g) | ||
| C. | PCl5?PCl3(g)+Cl2(g) | D. | CaCO3(s)?CaO(g)+CO2 (g) |
5.下列关于金属的叙述中正确的是( )
| A. | 金属可能有氧化性 | B. | 金属具有导电性、导热性和延展性 | ||
| C. | 金属都能与盐酸反应 | D. | 金属都能与氧气反应 |
2.取一小块钠,放在燃烧匙里加热,下列实验现象中,正确的描述( )
①钠先熔化
②钠在空气中燃烧,放出黄色火花
③燃烧后得到浅黄色固体
④燃烧时火焰为黄色
⑤燃烧后得到白色固体.
①钠先熔化
②钠在空气中燃烧,放出黄色火花
③燃烧后得到浅黄色固体
④燃烧时火焰为黄色
⑤燃烧后得到白色固体.
| A. | ①② | B. | ①②③ | C. | ①④⑤ | D. | ①③④ |
3.在标准状态下,下列离子中Sm⊙为0的是( )
| A. | Na+ | B. | Cu2+ | C. | H+ | D. | Cl- |
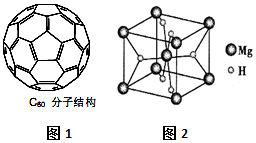 氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.
氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等. D.相同压强时,NH3沸点比PH3高
D.相同压强时,NH3沸点比PH3高