题目内容
7.如图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去.反应①常被应用于野外焊接钢轨,F是海水中含有盐的主要成分,J为D、G反应产物形成的水溶液.
请回答下列问题:
(1)B的化学式为Fe2O3.
(2)H的电子式为
 .
.(3)写出反应②的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2Na++OH-+H2↑+Cl2↑.
(4)写出反应④的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(5)D是目前应用最广泛的金属,D与炭混合物在水溶液中可形成许多微电池.将含有Cr2O72-的酸性废水通过该混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为Cr2O72-+6e-+14H+=2Cr3++7H2O.
分析 反应①常被应用于野外焊接钢轨判断为铝热反应,A和B为Al和铁的氧化物,依据转化关系CD为铁和氧化铝,F是海水中含有盐的主要成分,结合转化关系反应条件推断为NaCl,J为D、G反应产物形成的水溶液,可以继续和D反应生成K,K+H=M,M为Fe(OH)2,推断H为NaOH,G为Cl2,D为Fe,J为FeCL3,K为FeCl2,N为Fe(OH)3,N加热反应生成B为Fe2O3,推断铝热反应中A为Al,B为Fe2O3,C为Al2O3,E为NaAlO2;综上所述各物质为:A为Al,B为Fe2O3,C为Al2O3,D为Fe,E为NaAlO2,F为NaCl,G为Cl2,H为NaOH,J为FeCL3,K为FeCl2,I为H2,M为Fe(OH)2,N为Fe(OH)3,据此进行解答
解答 解:反应①常被应用于野外焊接钢轨判断为铝热反应,A和B为Al和铁的氧化物,依据转化关系CD为铁和氧化铝,F是海水中含有盐的主要成分,结合转化关系反应条件推断为NaCl,J为D、G反应产物形成的水溶液,可以继续和D反应生成K,K+H=M,M为Fe(OH)2,推断H为NaOH,G为Cl2,D为Fe,J为FeCL3,K为FeCl2,N为Fe(OH)3,N加热反应生成B为Fe2O3,推断铝热反应中A为Al,B为Fe2O3,C为Al2O3,E为NaAlO2;
根据分析可知:A为Al,B为Fe2O3,C为Al2O3,D为Fe,E为NaAlO2,F为NaCl,G为Cl2,H为NaOH,J为FeCL3,K为FeCl2,I为H2,M为Fe(OH)2,N为Fe(OH)3,
(1)B为氧化铁,化学式为Fe2O3,故答案为:Fe2O3;
(2)H为氢氧化钠,氢氧化钠为离子化合物,钠离子与氢氧根离子通过离子键结合而成,NaOH的电子式: ,
,
故答案为: ;
;
(3)反应②是电解饱和食盐水,反应离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2Na++OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2Na++OH-+H2↑+Cl2↑;
(4)反应④是氢氧化亚铁被氧气氧化为氢氧化铁,反应的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(5)D为Fe,D与炭混合物在水溶液中可形成许多微电池,铁作负极,生成亚铁离子,亚铁离子能还原Cr2O72-,所以将含有Cr2O72-的酸性废水通过该混合物,构成微电池,将Cr2O72-转化为Cr3+,铬的化合价降低,发生还原反应,所以在微电池正极上,其电极反应式为Cr2O72-+6e-+14H+=2Cr3++7H2O,
故答案为:正;Cr2O72-+6e-+14H+=2Cr3++7H2O.
点评 本题考查无机物的推断,题目难度中等,反应①的用途及M到N的现象等是推断突破口,需要学生熟练掌握元素化合物知识,试题培养了学生的分析能力及灵活应用能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 无水CuSO4 | B. | CuO | C. | Cu(OH)2 | D. | CuCO3 |
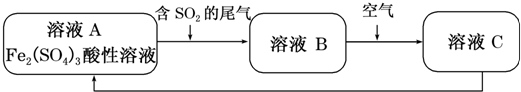
| A. | 向C溶液中滴加KSCN溶液,溶液变为血红色 | |
| B. | 溶液B转化为溶液C发生的变化的离子方程式为4H++2Fe2++O2═2Fe3++2H2O | |
| C. | 溶液酸性A>B>C | |
| D. | 加氧化亚铁可以使溶液C转化为溶液A |
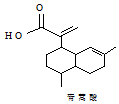
| A. | 青蒿酸的分子式为C15H20O2 | |
| B. | 1mol青蒿酸最多可与3molH2加成 | |
| C. | 青蒿酸与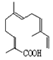 互为同分异构体 互为同分异构体 | |
| D. | 苯环上连有-CHO和-OH、分子中有6种不同化学环境氢的青蒿酸的同分异构体只有2种 |
| A. | a=$\frac{PM}{2000ρ}$ | B. | P=$\frac{200ρa}{M}$ | C. | P$\frac{1000ρ×a%}{M}$×2 | D. | V×ρ×a%=$\frac{PMV}{1000}$ |
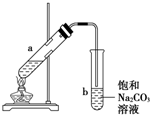
| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 | |
| D. | 长玻璃导管只有导气的作用 |