题目内容
下列说法中正确的是( )
| A、32gO3所含有的原子数目与1molO2所含原子物质的量相等 |
| B、4g金属钙变成钙离子时失去的电子数目为0.1NA |
| C、1molCH3+所含的电子数为10NA |
| D、标准状况下,22.4L H2O所含的分子数为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.质量转化为物质的量结合臭氧、氧气分子的构成解答;
B.计算40g金属钙变成钙离子失去的电子数,再计算4g金属钙变成钙离子时失去的电子数;
C.碳正离子中含有8个电子,1molCH3+(碳正离子)中含有8mol电子;
D.标准状况下,水为液体.
B.计算40g金属钙变成钙离子失去的电子数,再计算4g金属钙变成钙离子时失去的电子数;
C.碳正离子中含有8个电子,1molCH3+(碳正离子)中含有8mol电子;
D.标准状况下,水为液体.
解答:
解:A.32gO3所含有的原子物质的量=
×3=2mol,1molO2所含原子的物质的量1mol×2=2mol,故A正确;
B.40g金属钙变成钙离子时失去的电子数目为2NA,所以4g金属钙变成钙离子时失去的电子数目为0.2NA,故B错误;
C.1molCH3+(碳正离子)中含有8mol电子,含有电子数为8NA,故B错误;
D.标准状况下,水为液体,不能利用Vm计算,故D错误;
故选:A.
| 32g |
| 48g/mol |
B.40g金属钙变成钙离子时失去的电子数目为2NA,所以4g金属钙变成钙离子时失去的电子数目为0.2NA,故B错误;
C.1molCH3+(碳正离子)中含有8mol电子,含有电子数为8NA,故B错误;
D.标准状况下,水为液体,不能利用Vm计算,故D错误;
故选:A.
点评:本题考查阿伏加德罗常数,注意物质的组成、结构、性质、存在条件和物质的聚集状态,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列对分子性质的解释中,不正确的是( )
| A、碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 |
B、由于乳酸(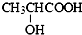 )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子 )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子 |
| C、HF的稳定性很强,是因为其分子间能形成氢键 |
D、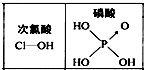 由图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子 |
下列有关结构和性质的说法中,正确的是( )
| A、因为酸性:HCl>H2CO3,所以非金属性:Cl>C |
| B、第ⅦA元素从上到下,其氢化物的稳定性逐渐增强 |
| C、同周期第ⅡA族与第IIIA族的元素原子序数之差不一定为1 |
| D、同周期主族元素的原子形成的简单离子电子层结构相同 |
将标准状况下a L HCl(g)溶于100g水中,得到的盐酸的密度为b g?cm-3,则该盐酸的物质的量浓度是( )
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
下列物质属于有机物的是( )
| A、CaC2 |
| B、Na2CO3 |
| C、CO |
| D、CO(NH2)2 |