题目内容
6.以下离子中,半径最大的是( )| A. | Na+ | B. | K+ | C. | S2- | D. | Cl- |
分析 电子层越多的离子半径越大,电子层一样的离子,核电荷数越多半径越小,据此来回答.
解答 解:四种离子含有2个电子层的微粒半径小于含有2个电子层的微粒,电子排布相同的微粒,其核电荷数越大,离子半径越小,则离子半径:S2->Cl->K+>Na+,所以S2-的半径最大,
故选:C.
点评 本题考查学生离子半径大小的比较方法知识,注意知识的积累是解题的关键,难度不大,侧重于基础知识的考查.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
16.将SO2气体通入下列溶液中,观察不到明显现象的是( )
| A. | BaCl2 | B. | 石蕊溶液 | C. | 酸性KMnO4溶液 | D. | 氢硫酸 |
17.反应A2(g)+B2(g)→2AB(g)的能量变化如图所示,叙述正确的是( )
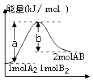

| A. | 该反应是放热反应 | |
| B. | 加入催化剂,(b-a)的差值减小 | |
| C. | 每生成2molAB分子吸收bkJ热量 | |
| D. | 若反应生成AB为液态,吸收的热量小于(a-b)kJ |
14.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,22.4 L氩气约含2 NA个氩原子 | |
| B. | 14 g乙烯和丙烯混合气体中含有2 NA个氢原子 | |
| C. | 标准状况下,2.24 L CCl4含有0.4 NA根共价键 | |
| D. | 1 mol N2与3 mol H2充分反应,生成2 NA个NH3分子 |
1.用饱和氯化钠溶液润湿的滤纸分别做甲、乙两个实验,下列判断错误的是( )

| A. | 甲是原电池,乙是电解池 | |
| B. | 甲中铁棒比乙中铁棒更易腐蚀 | |
| C. | d电极上的电极反应是:Fe-2e→Fe2+ | |
| D. | b电极上的电极反应是:O2+2H2O+4e→4OH- |
11.元素周期表中铊的数据如图,下列说法正确的是( )


| A. | 铊元素的质量数是204.4 | B. | 铊原子的中子数为81 | ||
| C. | 铊对应的氢氧化物有两性 | D. | 铊元素位于第ⅢA族 |
18.检验苯甲醛中是否含有苯甲醇可用的试剂是( )
| A. | 金属钠 | B. | 银氨溶液 | C. | 新制氢氧化铜 | D. | 饱和食盐水 |
15.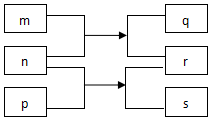 短周期主族元素X、Y、Z、W、R原子序数依次增大.m、p、r是这些元素组成的二元化合物,n、q、s是这些元素组成的三元化合物且属于离子化合物,其中s的水溶液俗称水玻璃,0.1mol/L n溶液的pH为13,m可制作耐火管且属于两性物质.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W、R原子序数依次增大.m、p、r是这些元素组成的二元化合物,n、q、s是这些元素组成的三元化合物且属于离子化合物,其中s的水溶液俗称水玻璃,0.1mol/L n溶液的pH为13,m可制作耐火管且属于两性物质.上述物质的转化关系如图所示.下列说法正确的是( )
 短周期主族元素X、Y、Z、W、R原子序数依次增大.m、p、r是这些元素组成的二元化合物,n、q、s是这些元素组成的三元化合物且属于离子化合物,其中s的水溶液俗称水玻璃,0.1mol/L n溶液的pH为13,m可制作耐火管且属于两性物质.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W、R原子序数依次增大.m、p、r是这些元素组成的二元化合物,n、q、s是这些元素组成的三元化合物且属于离子化合物,其中s的水溶液俗称水玻璃,0.1mol/L n溶液的pH为13,m可制作耐火管且属于两性物质.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 离子半径大小:Y>Z>W | |
| B. | 简单气态氢化物的稳定性:R>Y | |
| C. | W的最高价氧化物对应的水化物碱性比Z的强 | |
| D. | 单质熔点:Z>R>X |
15.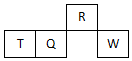 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中只有T为金属元素.下列判断错误的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中只有T为金属元素.下列判断错误的是( )
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中只有T为金属元素.下列判断错误的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中只有T为金属元素.下列判断错误的是( )| A. | 原子半径:T>Q | |
| B. | 元素非金属性:Q>R | |
| C. | 气态氢化物的热稳定性:R>Q | |
| D. | 最高价氧化物对应水化物的酸性:W>Q |