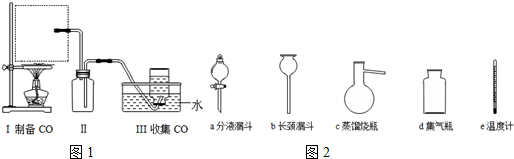
题目内容
16.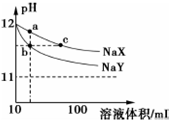 常温下,体积均为10mL、pH均为12的NaX和NaY两种钠盐溶液,分别加水稀释,pH随溶液体积的变化如图所示.下列叙述错误的是( )
常温下,体积均为10mL、pH均为12的NaX和NaY两种钠盐溶液,分别加水稀释,pH随溶液体积的变化如图所示.下列叙述错误的是( )| A. | 相同温度下,电离平衡常K(HX)<K(HY) | |
| B. | b、c两点溶液中水的电离程度相同 | |
| C. | a点溶液中:c(H+)+c(HX)=c(OH-) | |
| D. | b、c两点溶液中Na+的物质的量:nb(Na+)<nc(Na+) |
分析 A、由图象可知,起始pH均为12的NaX和NaY两种钠盐溶液加水稀释后,NaX溶液的pH下降较慢,故HX的酸性较HY更弱;
B、b和c两点,水的电离均被促进,且溶液的pH相同;
C、a点溶液中所有的氢离子和氢氧根均来自于水的电离,根据质子守恒来分析;
D、b、c两点溶液中钠离子的物质的量分别与起始时溶液中的钠离子的物质的量相同.
解答 解:A、NaX、NaY两种强碱弱酸盐溶液稀释相同的倍数时,pH变化大的说明该盐的水解程度小,其阴离子对应的酸的酸性强,故电离平衡常数K(HX)<K(HY),故A正确;
B、b、c两点的pH相同,对水的电离的促进程度相同,即两点溶液中水的电离程度相同,故B正确;
C、a点溶液中所有的氢离子和氢氧根均来自于水的电离,而水电离出的氢离子和氢氧根的浓度永远相等,但氢离子部分被X-结合为HX,故根据质子守恒可知c(H+)+c(HX)=c(OH-),故C正确;
D、b、c两点溶液中钠离子的物质的量分别与起始时溶液中的钠离子的物质的量相同,而起始时,由于酸性HX弱于HY,故要使NaX和NaY两种钠盐溶液的pH均为12,则必须c(NaX)<c(NaY),而溶液体积又均为10mL,故初始溶液中n(NaX)<n(NaY),则b、c两点的钠离子的物质的量nb(Na+)>nc(Na+),故D错误.
故选D.
点评 本题考查强碱弱酸盐的水解平衡及图象,明确图象中pH的变化及各点的意义是解答本题的关键,题目难度中等.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
6.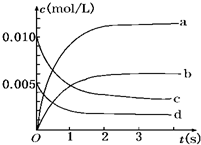 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)800℃,反应达到平衡时,NO的物质的量浓度是0.0035mol/L;
(2)图中表示NO2的变化的曲线是b.
(3)用O2表示从0~2s内该反应的平均速率v=0.0015mol•L-1•s-1.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的变化的曲线是b.
(3)用O2表示从0~2s内该反应的平均速率v=0.0015mol•L-1•s-1.
7.某元素的原子序数是34,则该基态原子中电子占据的原子轨道总数为( )
| A. | 17 | B. | 18 | C. | 19 | D. | 20 |
4.短周期元素A、B、C、D、E的原子序数依次增大,A的一中同位素的质量数为1,A和B同主族,C原子的最外层电子数是电子层数的3倍,D的最高正价与最低负价的绝对值相等,E的最高价氧化物的水化物的化学式为HnEO2n+2.下列说法正确的是( )
| A. | A与D可形成含18e-的离子化合物 | |
| B. | B单质在C单质中燃烧生成原子个数比为1:1的化合物 | |
| C. | D的氧化物为酸性氧化物,溶于水可制得D的含氧酸 | |
| D. | D与E组成的化合物中,各原子最外层均达到8电子结构 |
1.H2O2是常用的漂白剂和氧化剂,在环境保护、医药、化学合成等方面有重要的作用.
Ⅰ.为探究影响H2O2分解速率的因素,某实验小组进行了如下实验:
实验1:在相同的条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象.
实验2:
将质量相同但状态不同的MnO2分别加入盛有15mL5%的H2O2溶液的大试管中,并用带火星的木条测试,实验结果如下:
回答下列问题:
(1)H2O2的分解反应是放热反应(填放热或吸热).
(2)实验1的目的是研究FeCl3对H2O2分解反应速率的影响,加入1mLH2O的作用是保持两支试管中H2O2的浓度相等.
(3)实验2的实验结果表明,催化剂的催化效果与催化剂接触面积有关.
(4)实验室检验Fe3+的实验方法是取少量的FeCl3溶液于试管中,加入几滴KSCN溶液,溶液显血红色.
Ⅱ.一条件下,H2O2在水溶液中发生复分解反应的过程中,实验测得不同时间H2O2的物质的量浓度如下表:
(1)该分解反应0~40min的平均反应速率v(H2O2)为0.015mol•L-1•min-1.
(2)如果反应所用的H2O2溶液为200mL,则0~80min共产生O22.4g.(写出计算过程)
Ⅰ.为探究影响H2O2分解速率的因素,某实验小组进行了如下实验:
实验1:在相同的条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象.
实验2:
将质量相同但状态不同的MnO2分别加入盛有15mL5%的H2O2溶液的大试管中,并用带火星的木条测试,实验结果如下:
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)H2O2的分解反应是放热反应(填放热或吸热).
(2)实验1的目的是研究FeCl3对H2O2分解反应速率的影响,加入1mLH2O的作用是保持两支试管中H2O2的浓度相等.
(3)实验2的实验结果表明,催化剂的催化效果与催化剂接触面积有关.
(4)实验室检验Fe3+的实验方法是取少量的FeCl3溶液于试管中,加入几滴KSCN溶液,溶液显血红色.
Ⅱ.一条件下,H2O2在水溶液中发生复分解反应的过程中,实验测得不同时间H2O2的物质的量浓度如下表:
| t/min | 0 | 20 | 40 | 60 | 80 |
| C(H2O2)/mol•L-1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
(2)如果反应所用的H2O2溶液为200mL,则0~80min共产生O22.4g.(写出计算过程)
5.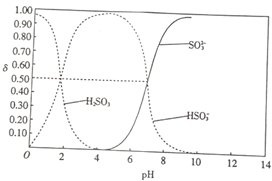 25℃时,向100mL 1mol•L-1H2SO3溶液中逐渐滴入1mol•L-1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pKs=-lgK,25℃时,H2SO3的pKa1=1.85,pKa2=7.19).下列说法不正确的是( )
25℃时,向100mL 1mol•L-1H2SO3溶液中逐渐滴入1mol•L-1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pKs=-lgK,25℃时,H2SO3的pKa1=1.85,pKa2=7.19).下列说法不正确的是( )
 25℃时,向100mL 1mol•L-1H2SO3溶液中逐渐滴入1mol•L-1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pKs=-lgK,25℃时,H2SO3的pKa1=1.85,pKa2=7.19).下列说法不正确的是( )
25℃时,向100mL 1mol•L-1H2SO3溶液中逐渐滴入1mol•L-1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pKs=-lgK,25℃时,H2SO3的pKa1=1.85,pKa2=7.19).下列说法不正确的是( )| A. | pH=1.85时,c(H2SO3)=c(HSO3-) | |
| B. | pH=6时,c(Na+)>c(HSO3-)>c(SO32-) | |
| C. | pH=7.19时,c(Na+)+c(H+)=c(HSO3-)+2c(SO3-)+c(OH-) | |
| D. | 加入150mLNaOH溶液时,3c(Na+)=2c(H2SO3)+2c(HSO3-)+2c(SO32-) |
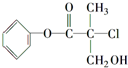 某有机物A是农药生产中的一种中间体,其结构简式如图所示.
某有机物A是农药生产中的一种中间体,其结构简式如图所示.