题目内容
6.亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2NH+H2═LiNH2+LiH,下列有关说法正确的是( )| A. | Li2NH中N的化合价是-1 | B. | 该反应中H2既是氧化剂又是还原剂 | ||
| C. | H-的离子半径比Li+大 | D. | 此法储氢和钢瓶储氢的原理相同 |
分析 Li2NH中H元素的化合价是+1,氮元素的化合价为-3;LiNH2中氮元素的化合价为-3,H元素的化合价是+1;LiH中H元素的化合价是-1,可以从化合价变化的角度来判断氧化还原反应的有关概念;离子核外电子层数越多,半径越大;钢瓶储氢是物理过程.
解答 解:A.Li2NH中氮元素的化合价为-3,故A错误;
B.反应物H2中的氢元素的化合价为0价,反应后生成LiNH2中H元素的化合价是+1,LiH中H元素的化合价是-1,所以H2既是氧化剂又是还原剂,故B正确;
C.LiH中的阳离子和阴离子核外电子排布相同,核电核数越大,半径越小,则Li+半径小于H-半径,故C正确;
D.钢瓶储氢是物理过程,而该方法为化学方法,故D错误.
故选BC.
点评 本题考查氧化还原反应的有关概念,离子半径的大小比较等问题,做题注意从化合价变化的角度判断氧化剂、还原剂的等概念,注意离子半径大小比较的方法,注重基础知识的积累.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
17.氮元素有着多变价态和种类繁多的化合物,它们在工农业生产、生活中发挥着重要的作用.完成下列问题:
(1)在一密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如下表:
①比较K1、K2的大小:K1>K2(填“>”、“=”或“<”).
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是acd(填序号).
a.2v正(H2)=3v逆(NH3) b.容器内N2、H2和NH3浓度相等的状态
c.容器内压强保持不变 d.混合气体的平均摩尔质量保持不变
③若维持容器的体积不变,达到平衡状态后再向容器中通入一定量的N2,此时逆反应速率不变(填“增大”、“减小”或“不变”);平衡向正反应方向移动(填“正反应”或“逆反应”).
④已知AgCl可溶于氨水中,而AgBr不溶于氨水中,则Ksp(AgCl)> Ksp(AgBr).
(2)肼是氮元素的另一种氢化物,分子式为N2H4.
①写出肼的电子式 .
.
②298K时,1.00g N2H4(l)与足量的N2O4(l)完全反应生成氮气和液态水,放出19.15kJ的热量.写出该反应的热化学方程式2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1225.6kJ/mol.
③肼也可以在纯氧中燃烧生成氮气和水,为了充分利用其能量有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,请写出负极反应式N2H4-4e-═N2+4H+.
(1)在一密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如下表:
| T | 298K | 398K | 498K | … |
| K | 4.1×106 | K1 | K2 | … |
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是acd(填序号).
a.2v正(H2)=3v逆(NH3) b.容器内N2、H2和NH3浓度相等的状态
c.容器内压强保持不变 d.混合气体的平均摩尔质量保持不变
③若维持容器的体积不变,达到平衡状态后再向容器中通入一定量的N2,此时逆反应速率不变(填“增大”、“减小”或“不变”);平衡向正反应方向移动(填“正反应”或“逆反应”).
④已知AgCl可溶于氨水中,而AgBr不溶于氨水中,则Ksp(AgCl)> Ksp(AgBr).
(2)肼是氮元素的另一种氢化物,分子式为N2H4.
①写出肼的电子式
 .
.②298K时,1.00g N2H4(l)与足量的N2O4(l)完全反应生成氮气和液态水,放出19.15kJ的热量.写出该反应的热化学方程式2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1225.6kJ/mol.
③肼也可以在纯氧中燃烧生成氮气和水,为了充分利用其能量有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,请写出负极反应式N2H4-4e-═N2+4H+.
1.下列说法中正确的是( )
| A. | 式量相同的物质是同种物质 | |
| B. | 分子式相同的不同有机物一定是同分异构体 | |
| C. | 具有同一通式的物质属于同系物 | |
| D. | 分子中含有碳与氢的化合物是烃类 |
11.将过量的CO2分别通入:①CaCl2溶液 ②NaAlO2溶液 ③Ca(OH)2溶液 ④饱和Na2CO3溶液.最终溶液中有白色沉淀析出的是( )
| A. | ①②③④ | B. | ②④ | C. | ①②③ | D. | ②③ |
18.下列有关硅的叙述中,正确的是( )
| A. | SiO2与CO2相似,由一个硅原子和两个氧原子构成一个SiO2分子 | |
| B. | 硅酸盐一般不溶于水,它是水泥、陶瓷、玻璃的主要成分 | |
| C. | SiO2是酸性氧化物,能和碱反应,不能和酸反应 | |
| D. | 硅元素是构成矿物岩石的主要成分之一,其化合态几乎全部是氧化物和硅酸盐 |
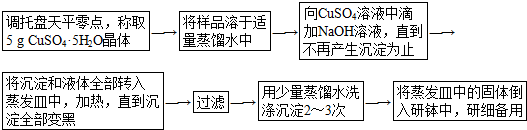
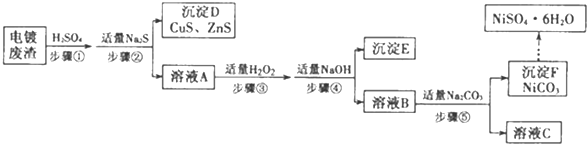
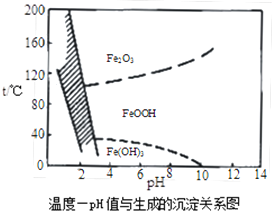
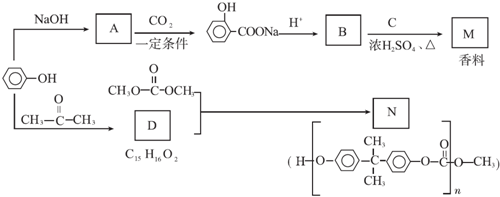
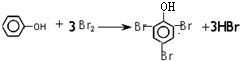 .
. ;
; +
+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$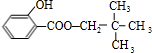 +H2O.
+H2O.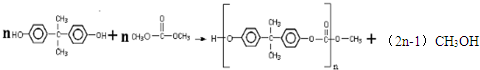 ,反应类型为缩聚反应.
,反应类型为缩聚反应.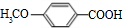 .
.