题目内容
16.黄铜矿(主要成分CuFeS2)是提取铜的主要原料(1)取12.5g黄铜矿样品,经测定含3.60g硫(杂质不含硫),矿样中CuFeS2含量为82.8%
(2)已知,产物Cu2S在1200℃高温下继续反应:2Cu2S+3O2→2Cu2O+2SO22Cu2O+Cu2S→6Cu+SO2
假定各步反应都完全,完成下列计算:
①由6mol CuFeS2生成6mol Cu,消耗O2的物质的量15mol.
②6mol CuFeS2和14.25mol O2反应,理论上可得到4.5摩尔铜.
分析 (1)m(样品)×ω(CuFeS2)×CuFeS2中S元素的质量分数=m(S);
(2)①由反应可知,最终CuFeS2与O2反应的最终成为FeO、Cu、SO2,根据原子守恒计算n(FeO)、n(SO2),根据O原子守恒可知2n(O2)=n(FeO)+n(SO2);
②根据方程式计算6mol CuFeS2消耗O2的物质的量、生成Cu2S的物质的量,进而计算剩余O2的物质的量.根据2Cu2S+3O2=2Cu2O+2SO2计算反应的Cu2S的物质的量、生成Cu2O的物质的量,进而计算剩余Cu2S的物质的量,再根据2Cu2O+Cu2S→6Cu+SO2进行过量计算.
解答 解:(1)12.5g×ω(CuFeS2)×=3.6g,解得ω(CuFeS2)=82.8%,故答案为:82.8%;
(2)①由反应可知,最终CuFeS2与O2反应的最终成为FeO、Cu、SO2,根据原子守恒n(FeO)=n(CuFeS2)=6mol,n(SO2)=2n(CuFeS2)=12mol,根据O原子守恒可知2n(O2)=n(FeO)+2n(SO2)=6mol+12mol×2,故n(O2)=15mol,
答:消耗O2的物质的量为15mol;
②2CuFeS2+4O2 =Cu2S+3SO2+2FeO,
6mol 12mol 3mol
故剩余氧气为14.25mol-12mol=2.25mol,生成Cu2S为3mol,
2Cu2S+3O2=2Cu2O+2SO2;
3mol 4.5mol
故氧气不足,故氧气完全反应,按照氧气计算,
2Cu2S+3O2 =2Cu2O+2SO2
x 2.25mol y
生成Cu2O为2.25mol×$\frac{2}{3}$=1.5mol
消耗的Cu2S为2.25mol×$\frac{2}{3}$=1.5mol,则剩余Cu2S为3mol-1.5mol=1.5mol,
2Cu2O+Cu2S=6Cu+SO2;
1.5mol 1.5mol z
故氧化亚铜完全反应,则生成铜z=1.5mol×$\frac{6}{2}$=4.5mol,
故答案为:4.5.
点评 本题考查混合物的有关计算,题目过程复杂,计算量很大,为易错题目,对学生的心理素质有较高的要求,注意原子守恒计算与过量计算.

| A. | 35Cl原子所含质子数为18 | |
| B. | $\frac{1}{18}$ mol的1H35Cl分子所含中子数约为6.02×1023 | |
| C. | 3.5 g的35Cl2气体的体积为2.24 L | |
| D. | 35Cl2气体的摩尔质量为70 g•mol-1 |
| A. | 0.5 mol/L | B. | 0.4 mol/L | C. | 0.3 mol/L | D. | 0.2 mol/L |
| A. | 浓度为0.1mol•L-1 CH3COOH溶液,加水稀释,则$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$减小 | |
| B. | 浓度为0.1mol•L-1 CH3COOH溶液,升高温度,Ka (CH3COOH)不变,但醋酸的电离程度增大 | |
| C. | 在稀AgNO3溶液中先加入过量0.1mol/L NaCl溶液,再加入少量0.1mol/L Na2S溶液,先产生白色沉淀,后出现黑色沉淀,说明Ksp(AgCl)>Ksp(Ag2S) | |
| D. | 在恒容密闭容器中,反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0达到平衡后,使用高效催化剂,正反应速率增加,逆反应速率减小,平衡正向移动 |
| A. | 石灰水、裂化汽油 | B. | NaHS溶液、SO2 | ||
| C. | NaCl溶液、NaI溶液 | D. | CaCl2溶液、Na2S溶液 |
| A. | 一定是酸溶液 | B. | 一定是强酸弱碱盐的溶液 | ||
| C. | 一定是酸性溶液 | D. | 一定是能使甲基橙试液变红的溶液 |
| A. | 含0.1NA个CO32-的Na2CO3固体的质量为10.6g | |
| B. | 含1mol HCl的盐酸与足量Fe反应,Fe失去的电子总数为2NA | |
| C. | 水的摩尔质量就是NA个水分子的质量之和 | |
| D. | 2mol氦气含有电子数为8NA |
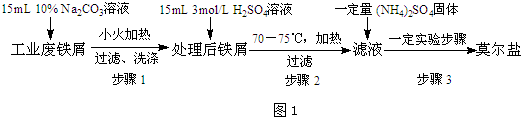
 A,B,C是三种短周期元素的单质,甲、乙是两种常见的化合物.这些单质和化合物之间存在如图所示关系.写出符合如图关系的A,B,C的化学式,(1)~(3)中的A不在同一主族.
A,B,C是三种短周期元素的单质,甲、乙是两种常见的化合物.这些单质和化合物之间存在如图所示关系.写出符合如图关系的A,B,C的化学式,(1)~(3)中的A不在同一主族.