题目内容
4.硫酸亚铁铵又称莫尔盐,是浅绿色晶体.它在空气中比一般亚铁盐稳定,是常用的Fe2+试剂.某实验小组利用工业废铁屑制取莫尔盐,并测定其组成,他们进行了以下实验.Ⅰ.莫尔盐的制取
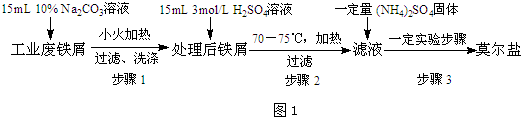
(把图中“一定实验步骤”换成“加热蒸发、浓缩结晶”)
请回答下列问题.
(1)废铁屑中含氧化铁,无需在制备前除去,理由是Fe2O3+6H+═2Fe3++3H2O、2Fe3++Fe═3Fe2+(用离子方程式回答),实验前都需将废铁屑放入碳酸钠溶液中煮沸,倾倒出液体,用水洗净铁屑.从以下仪器中选择组装,完成该操作必需的仪器有③⑦ (填编号).
①铁架台 ②玻璃棒 ③广口瓶 ④石棉网 ⑤烧杯 ⑥漏斗 ⑦酒精灯
(2)步骤2中加热方式水浴加热(填“直接加热”﹑“水浴加热”或“沙浴”);必须在铁屑少量剩余时,进行热过滤,其原因是防止Fe2+被氧化,同时热过滤可防止硫酸亚铁以晶体形式析出.
Ⅱ.莫尔盐组成的测定
①将摩尔盐低温烘干后,称取7.84 g加热至100℃失去结晶水,质量变为5.68g.
②选择下图所示的部分装置连接起来,检查气密性后,将上述5.68g固体放入A装置的锥形瓶中,再向锥形瓶中加入足量NaOH浓溶液,充分吸收产生的气体并测出气体质量为0.68g.
③向A中加入适量3%的H2O2溶液,充分振荡后滤出沉淀,洗净、干燥、灼烧后,测得其质量为1.6g.
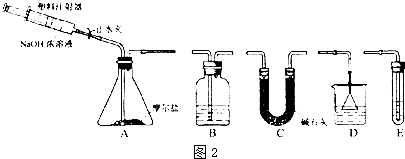
根据上述实验回答下列问题.
(3)步骤②中,选择的装置是A接C接D(填代号),A装置中未使用分液漏斗的理由是NaOH溶液对分液漏斗活塞、旋塞的磨口腐蚀性强.
(4)向锥形瓶中加入NaOH溶液的操作方法是打开止水夹,缓慢推压注射器活塞;吸收A中产生的气体所用试剂应是H2SO4溶液.实验小组的同学为保证A中产生的气体被完全吸收以准确测量其质量,他们在A中反应停止后再进行的操作是用注射器向A中注入空气,使装置中的氨气全部进入吸收液.
(5)根据上述实验数据计算,摩尔盐中n(N${H}_{4}^{+}$):n(Fe2+):n(S${O}_{4}^{2-}$):n(H2O)=2:1:2:6.
分析 (1)从滤液到得到晶体需要加热浓缩、冷却结晶、过滤、洗涤干燥等过程;步骤是溶液的加热和过滤,结合加热与过滤基本操作选择仪器;
(2)水浴加热便于控制温度;亚铁离子易被氧化,少量铁还原氧化生成的Fe3+;FeSO4在温度低时溶解度较小;
(3)莫尔盐与氢氧化钠溶液反应生成氨气,可用稀硫酸吸收,注意防止倒吸,氢氧化钠具有强腐蚀性,可与二氧化硅反应;
(4)加入氢氧化钠溶液时,应先打开止水夹,缓慢推压注射器活塞,用稀硫酸吸收氨气,为保证气体完全吸收,可用注射器向A中注入空气;
(5)由题给数据可知7.84g摩尔盐中m(H2O)=7.84g-5.68g=2.16g,生成的m(NH3)=0.68g,m(Fe2O3)=1.6g,以此可确定SO42-的质量以及n(NH4+):n(Fe2+):n((SO42-):n(H2O)的比值.
解答 解:(1)废铁中含氧化铁,无需制备前除去,因最终溶液是FeSO4溶液,氧化铁和硫酸生成硫酸铁、铁和硫酸铁生成硫酸亚铁,离子方程式为:Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+,步骤是溶液的加热和过滤,需要的仪器有:铁架台、烧杯、玻璃棒、酒精灯、石棉网,故不需要广口瓶、漏斗,
故答案为:Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+;③⑦;
(2)步骤二实验需要温度为:70~75℃,采用水浴加热便于控制温度;亚铁离子易被氧化,少量铁可还原氧化生成的Fe3+,减少产物中的Fe3+杂质,如果不趁热过滤就会有FeSO4•7H2O析出;
故答案为:水浴加热;防止Fe2+被氧化,同时热过滤可防止硫酸亚铁以晶体形式析出;
(3)莫尔盐与氢氧化钠溶液反应生成氨气,生成氨气先用碱石灰干燥,以除去水,然后用稀硫酸在D装置内吸收氨气,以防止倒吸,氢氧化钠具有强腐蚀性,可与二氧化硅反应,则可用注射器加入氢氧化钠溶液,
故答案为:C;D; NaOH溶液对分液漏斗活塞、旋塞的磨口腐蚀性强;
(4)加入氢氧化钠溶液时,应先打开止水夹,缓慢推压注射器活塞,用稀硫酸吸收氨气,为保证气体完全吸收,可用注射器向A中注入空气,使装置中的氨气全部进入吸收液,
故答案为:打开止水夹,缓慢推压注射器活塞;H2SO4溶液;用注射器向A中注入空气,使装置中的氨气全部进入吸收液;
(5)由题给数据可知7.84g摩尔盐中m(H2O)=7.84g-5.68g=2.16g,n(H2O)=$\frac{2.16g}{18g/mol}$=0.12mol,
生成的m(NH3)=0.68g,m(Fe2O3)=1.6g,
则n(NH3)=$\frac{0.68g}{17g/mol}$=0.04mol,n(Fe2O3)=$\frac{1.6g}{160g/mol}$=0.01mol,
则m(NH4+)=0.04mol×18g/mol=0.72g,m(Fe2+)=0.02mol×56g/mol=1.12g,
则m(SO42-)=7.84g-2.16g-0.72g-1.12g=3.84g,
n(SO42-)=$\frac{3.84g}{96g/mol}$=0.04mol,
所以n(NH4+):n(Fe2+):n((SO42-):n(H2O)=0.04mol:0.02mol:0.04mol:0.12mol=2:1:2:6,
故答案为:2:1:2:6.
点评 本题考查物质的含量测定,侧重于学生的分析能力、计算能力和实验能力的考查,题目难度不大,注意把握相关实验基本方法和注意事项.

 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案| A. | 甲指着氢气燃烧的实验装置说:“一种物质发生反应后,如果有水生成,我认为该物质中一定含有氢元素.” | |
| B. | 乙回答:“可能是这样,但我不能肯定.” | |
| C. | 乙指着实验桌上一瓶无色气体说:“这瓶无色的气体如果点燃后能燃烧并生成水,我认为这是一瓶氢气.” | |
| D. | 甲回答:“可能是这样,但我也不能肯定.” |
 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.(1)选择制取SO2的合适试剂②③(填编号).
①浓HCl ②浓H2SO4 ③Na2SO3 固体 ④CaSO3 固体
(2)上述装置还可优化,优化的方法是在A和B之间未连接一干燥装置,装置C中NaOH溶液的作用是吸收多余的SO2,防止污染环境.
(3)甲同学推测Mg 与SO2的反应与CO2相似,则该反应方程式为2Mg+SO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+S.
乙同学的推测是:2Mg+3SO2=2MgSO3+S;丙同学的推测是:3Mg+SO2=2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;H2S气体通入CuSO4溶液中出现黑色沉淀.
限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/L NaOH、品红溶液、澄清石灰水、2mol/L CuSO4;仪器和用品自选.
| 序号 | 实验步骤 | 预期现象和结论 |
| 1 | 取少量反应后所得固体于试管中 | |
| 2 | 向试管中的固体慢慢滴加2mol/L 盐酸至过量,试管口塞上导管的单孔塞,并将导管通入盛有品红的试管中 | 若试管中的固体完全溶解,则丙同学推测正确.若试管中的固体未完全溶解,且品红溶液褪色,则乙同学推测正确. |
(4)上述实验需要100mL,2mol/L 的HCl,配制时选用25mL(选填10mL、25mL、50mL 或100mL)量筒量取36.5%,密度1.19g/mL 的浓盐酸的体积为16.8mL.


 .
.