题目内容
写出下列反应的离子方程式:
(1)硫酸与氢氧化钡溶液反应:
(2)碳酸钙与盐酸反应:
(3)氯化铁溶液加入氢氧化钠溶液中: .
(1)硫酸与氢氧化钡溶液反应:
(2)碳酸钙与盐酸反应:
(3)氯化铁溶液加入氢氧化钠溶液中:
考点:离子方程式的书写
专题:
分析:(1)氢氧化钡与硫酸反应生成硫酸钡沉淀和弱电解质水,离子方程式中硫酸钡和水都需要保留化学式;
(2)碳酸钙与稀盐酸反应生成氯化钙、二氧化碳气体和水,碳酸钙需要保留化学式;
(3)氯化铁与氢氧化钠反应生成氯化钠和氢氧化铁,氢氧化铁需要保留化学式.
(2)碳酸钙与稀盐酸反应生成氯化钙、二氧化碳气体和水,碳酸钙需要保留化学式;
(3)氯化铁与氢氧化钠反应生成氯化钠和氢氧化铁,氢氧化铁需要保留化学式.
解答:
解:(1)氢氧化钡与稀硫酸反应生成硫酸钡和水,反应的离子方程为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
(2)碳酸钙与稀盐酸反应生成氯化钙、二氧化碳气体和水,反应的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;
(3)氯化铁与氢氧化钠反应生成氯化钠和氢氧化铁,反应的离子方程式为:Fe3++3OH-=Fe(OH)3↓,故答案为:Fe3++3OH-=Fe(OH)3↓.
(2)碳酸钙与稀盐酸反应生成氯化钙、二氧化碳气体和水,反应的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;
(3)氯化铁与氢氧化钠反应生成氯化钠和氢氧化铁,反应的离子方程式为:Fe3++3OH-=Fe(OH)3↓,故答案为:Fe3++3OH-=Fe(OH)3↓.
点评:本题考查了离子方程式的书写,题目难度中等,注意掌握离子方程式的概念、表示意义及书写原则,明确需要保留化学式的物质,如难溶物、弱电解质、氧化物,还要区别离子方程式满足守恒关系,如:质量守恒定律、电荷守恒、电子守恒.

练习册系列答案
相关题目
下列反应的化学方程式或离子方程式表示正确的是( )
A、乙酸与乙醇的反应CH3COOH+CH3CH218OH
| ||||
| B、苯酚钠溶液和少量CO2反应:2C6H5O-+CO2+H2O=2C6H5OH+CO32- | ||||
| C、用醋酸去除水垢:CaCO3+2H+=Ca2++CO2↑+H2O | ||||
D、用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH4)2OH
|
关于阿伏加德罗常数的说法正确的是( )
| A、0.1 L 3.0 mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3NA |
| B、9g SiO2晶体中含有的硅氧键数目为0.3NA |
| C、30 g甲醛中含共用电子对总数为4NA |
| D、10 g 46%的乙醇水溶液中所含H原子个数为0.6NA |
下列化学用语或模型图正确的是( )
| A、HClO的结构式:H-Cl-O |
B、CO2的比例模型: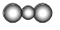 |
C、146C的原子结构示意图: |
D、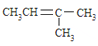 的名称:3-甲基-2-丁烯 的名称:3-甲基-2-丁烯 |
根据图式,下列热化学方程式书写正确的是( )
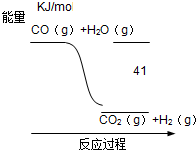

| A、CO+H2O═CO2+H2 △H=-41 KJ/mol |
| B、CO(g)+H2O(g)═CO2(g)+H2(g)△H=+41 KJ/mol |
| C、CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41 KJ/mol |
| D、CO2(g)+H2(g)═CO(g)+H2O(g)△H=-41 KJ/mol |
下列说法中正确的是( )
| A、用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味 |
| B、用排水集气法便可以收集到纯净的氯气 |
| C、干燥的氯气有漂白性 |
| D、自来水常用氯气来杀菌、消毒 |