题目内容
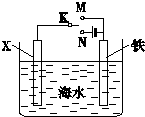 (1)利用如图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于
(1)利用如图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于(2)肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料.肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液.该电池放电时,通入肼的一极为
电极反应式是
(3)碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.
以碘为原料,可通过电解制备碘酸钾.(阴、阳两极均用惰性电极,阴极室与阳极室用阳离子交换膜隔开)请回答下列问题:
电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.电解时,阳极上发生反应的电极反应式为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)作原电池正极或作电解池阴极的金属被保护;
(2)肼--空气燃料电池是一种碱性燃料电池,工作时,负极上肼失电子发生氧化反应,根据原电池总反应式可判断溶液pH的变化;
(3)阳极上阴离子放电发生氧化反应.
(2)肼--空气燃料电池是一种碱性燃料电池,工作时,负极上肼失电子发生氧化反应,根据原电池总反应式可判断溶液pH的变化;
(3)阳极上阴离子放电发生氧化反应.
解答:
解:(1)作原电池正极或作电解池阴极的金属被保护,若X为碳棒,为减缓铁的腐蚀,则铁应作电解池阴极,所以开关K应该置于处N处;
若X为锌,开关K置于M处,该装置构成原电池,锌易失电子作负极,铁作正极而被保护,该电化学防护法称为牺牲阳极的阴极保护法,
故答案为:N;牺牲阳极的阴极保护法;
(2)肼--空气燃料电池是一种碱性燃料电池工作时,负极上肼失电子发生氧化反应,电极反应式为N2H4-4e-+4OH-=N2↑+4H2O,电池总反应式为N2H4+O2=N2+2H2O,由总反应式可知,反应生成水,OH-浓度减小,则pH减小,
故答案为:负极,N2H4-4e-+4OH-=N2↑+4H2O,减小;
(3)阳极附近的阴离子有碘离子、碘酸根离子和氢氧根离子,电解过程中阳极上碘离子失电子生成碘单质,电极反应式为:2I--2e-=I2,
故答案为:2I--2e-=I2.
若X为锌,开关K置于M处,该装置构成原电池,锌易失电子作负极,铁作正极而被保护,该电化学防护法称为牺牲阳极的阴极保护法,
故答案为:N;牺牲阳极的阴极保护法;
(2)肼--空气燃料电池是一种碱性燃料电池工作时,负极上肼失电子发生氧化反应,电极反应式为N2H4-4e-+4OH-=N2↑+4H2O,电池总反应式为N2H4+O2=N2+2H2O,由总反应式可知,反应生成水,OH-浓度减小,则pH减小,
故答案为:负极,N2H4-4e-+4OH-=N2↑+4H2O,减小;
(3)阳极附近的阴离子有碘离子、碘酸根离子和氢氧根离子,电解过程中阳极上碘离子失电子生成碘单质,电极反应式为:2I--2e-=I2,
故答案为:2I--2e-=I2.
点评:本题考查了原电池原理和电解池原理,明确电极上发生的反应是解本题关键,注意电极反应式的书写,为学习难点,题目难度中等.

练习册系列答案
相关题目
苹果酸的结构简式为 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A、苹果酸中能发生酯化反应的官能团有2种 |
| B、1mol苹果酸可与3mol NaOH发生中和反应 |
| C、1mol苹果酸与足量金属Na反应生成1mol H2 |
D、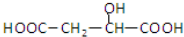 与苹果酸互为同分异构体 与苹果酸互为同分异构体 |
提纯下列物质(括号内为要除去的杂质)的方法,正确的是( )
| A、金(沙子)--过滤 |
| B、NaCl(泥沙)--溶解、过滤、蒸发 |
| C、碘(水)--用酒精萃取 |
| D、NaCl(MgCl2)--加硫酸钠、过滤 |
过渡元素高价化合物在酸性条件下有较强的氧化性,如KMnO4、Na2WO4(钨酸钠)等.现向50mL浓度为0.100mol/L的FeCl2溶液中加入25mL浓度为0.0400mol/L的KMnO4,在滴加少量的H2SO4后,两者恰好完全反应.则氧化剂KMnO4的还原产物可能为( )
| A、K2MnO4 |
| B、MnO2 |
| C、MnCl2 |
| D、Mn |
下列有关药品的保存说法错误的是( )
| A、过氧化钠、漂白粉要密封保存 |
| B、钠保存在四氯化碳中 |
| C、液氯可以保存钢瓶中 |
| D、溴化银和碘化银保存在棕色瓶中 |


 原电池是直接把化学能转化为电能的装置.
原电池是直接把化学能转化为电能的装置.