题目内容
实验室用MnO2与浓HCl制取Cl2:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,下列说法正确的是( )
| ||
| A、MnO2作氧化剂,发生氧化反应 |
| B、在反应中,表现还原性与表现酸性的HCl的物质的量之比为2:1 |
| C、每生成1mol Cl2时,有4mol电子发生转移 |
| D、氧化性:MnO2>Cl2 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:在反应中MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,Mn元素化合价降低,被还原,MnO2作氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,结合化合价的变化判断转移的电子数目.
| ||
解答:
解:A.MnO2作氧化剂,发生还原反应,MnCl2是还原产物,故A错误;
B.4molHCl参加反应,有2mol被氧化,2mol表现出酸性,则表现还原性与表现酸性的浓HCl物质的量之比为1:1,故B错误;
C.反应中Cl元素化合价变化由-1价到0价,每生成1mol Cl2时,有2mol电子发生转移,故C错误;
D.氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,则有氧化性:MnO2>Cl2,故D正确.
故选D.
B.4molHCl参加反应,有2mol被氧化,2mol表现出酸性,则表现还原性与表现酸性的浓HCl物质的量之比为1:1,故B错误;
C.反应中Cl元素化合价变化由-1价到0价,每生成1mol Cl2时,有2mol电子发生转移,故C错误;
D.氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,则有氧化性:MnO2>Cl2,故D正确.
故选D.
点评:本题考查氧化还原反应,题目难度不大,注意把握元素的化合价的变化,把握氧化还原反应的特征,根据化合价的变化计算转移电子的数目.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
关于电解质强弱及非电解质的组合完全正确的是( )
| A | B | C | D | |
| 强电解质 | NaCl | H2SO4 | CaCO3 | HNO3 |
| 弱电解质 | HF | BaSO4 | HClO | CH3COOH |
| 非电解质 | Cl2 | CO2 | C2H5OH | H2O |
| A、A | B、B | C、C | D、D |
饮用水的消毒剂有多种,其中杀菌能力强又不影响水质的理想消毒剂是( )
| A、臭氧(O3) |
| B、漂白剂 |
| C、苯酚 |
| D、氯气 |
下列物质的水溶液,由于水解而呈酸性的是( )
| A、NaCl |
| B、Na2CO3 |
| C、NaHSO4 |
| D、NH4Cl |
胶体区别于其他分散系的本质特征是( )
| A、光束穿过胶体时形成一条光亮的“通路” |
| B、胶体粒子大小在1 nm~100 nm之间 |
| C、胶体有电泳现象 |
| D、胶体粒子不能透过半透膜 |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )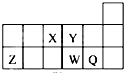

| A、元素X与元素Z的最高正化合价之和的数值等于7 |
| B、原子半径的大小顺序为:rZ>rW>rQ>rY>rX |
| C、离子Y2-和Z3+的核外电子数、电子层数和质子数都相同 |
| D、元素W的最高价氧化物对应的水化物的酸性比Q的弱 |
 如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答:
如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答: