题目内容
在10mL 0.01mol/L的纯碱溶液中,不断搅拌并逐渐加入1.2mL0.05mol/L盐酸,完全反应后,在标准状况下生成二氧化碳的体积为( )
| A、1.344mL |
| B、2.240mL |
| C、0.672mL |
| D、0mL |
考点:化学方程式的有关计算
专题:计算题
分析:纯碱中滴加盐酸,发生Na2CO3+HCl=NaCl+NaHCO3、NaHCO3+HCl=NaCl+CO2 ↑+H2O,当n(Na2CO3):n(HCl)≥1:1时,碳酸钠和盐酸反应生成碳酸氢钠,溶液中的溶质是碳酸氢钠和碳酸钠,没有气体生成,以此来解答.
解答:
解:纯碱中滴加盐酸,发生Na2CO3+HCl=NaCl+NaHCO3、NaHCO3+HCl=NaCl+CO2 ↑+H2O,
n(Na2CO3)=0.01L×0.01mol/L=0.0001mol,
n(HCl)=0.0012L×0.05mol/L=0.000006mol,
则n(Na2CO3):n(HCl)>1:1,只发生Na2CO3+HCl=NaCl+NaHCO3,不生成气体,气体体积为0,
故选D.
n(Na2CO3)=0.01L×0.01mol/L=0.0001mol,
n(HCl)=0.0012L×0.05mol/L=0.000006mol,
则n(Na2CO3):n(HCl)>1:1,只发生Na2CO3+HCl=NaCl+NaHCO3,不生成气体,气体体积为0,
故选D.
点评:本题考查化学反应方程式的计算,为高频考点,把握发生的化学反应及反应的先后顺序为解答的关键,侧重分析能力及计算能力的考查,题目难度不大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
下列叙述正确的是( )
| A、鉴别两种无色溶液Na2CO3与NaHCO3可以用石灰水 |
| B、Mg和Cu的冶炼方法一定要用相同方法:热还原法 |
| C、SO2与CO2对环境污染的原理:均形成酸雨 |
| D、Na2SiO3与Na2O?SiO2是同种物质:都是硅酸盐 |
体积比为1:3的A、B两种链烃的混合气体aL,可与0.5aL(状态相同)氢气发生加成反应,则A、B两种链烃的通式可能是( )
| A、CnH2n和CnH2n+2 |
| B、CnH2n-2和CnH2n+2 |
| C、CnH2n和CnH2n |
| D、CnH2n和CnH2n-2 |
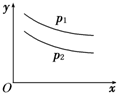 反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数;据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数;据此可判断( )| A、上述反应是放热反应 |
| B、上述反应是吸热反应 |
| C、a>b |
| D、无法确定a、b的大小 |
下列各组中的实验不能达到预期目的是( )
| A、用浓硫酸与溴化钠强热制溴化氢气体 |
| B、用盐酸酸化的硝酸钡检验亚硫酸钠是否被氧化 |
| C、用新制氢氧化铜鉴别甲醇、甲醛和甲酸溶液 |
| D、用溴水鉴别苯、苯酚和苯乙烯 |
下列说法中错误的是( )
| A、氨是一种易溶、易液化的气体 |
| B、氨的水溶液能使紫色石蕊试液变红色 |
| C、氨气不能用浓硫酸来干燥 |
| D、氨气在一定条件下能跟氧气反应 |
将铜和锌用导线连接插入硫酸铜溶液中,当导线中有0.2mol电子通过时,负极质量变化是( )
| A、增加6.5g |
| B、减少6.5g |
| C、减少5.6g |
| D、增加5.6g |