题目内容
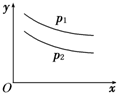 反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数;据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数;据此可判断( )| A、上述反应是放热反应 |
| B、上述反应是吸热反应 |
| C、a>b |
| D、无法确定a、b的大小 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:根据影响化学平衡的因素进行判断,升高温度,平衡向着吸热的方向移动;增大压强,平衡向着气体体积减小的方向移动,据此分析.
解答:
解:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数,则相同压强下,温度越高,G的体积分数越小,故升高温度,平衡正向移动,所以该反应为吸热反应;
相同温度时,压强越大,G的体积分数越大,则增大压强,平衡逆向移动,因L为固体,所以a<b,
故选B.
相同温度时,压强越大,G的体积分数越大,则增大压强,平衡逆向移动,因L为固体,所以a<b,
故选B.
点评:本题考查了温度、压强的变化对平衡移动的影响,注意图象分析中定一议二法的应用,题目难度中等.

练习册系列答案
相关题目
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示),下列有关说法正确的是( )

| A、第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
| B、加热蒸干氯化镁溶液获得氯化镁固体,通过电解熔融氯化镁冶炼金属镁 |
| C、从第③步到第⑤步的目的是为了富集溴 |
| D、在第③④⑤步中溴元素均被氧化 |
下列各项不正确的是( )
| A、等物质的量浓度的下列溶液中①NH4Al(SO4)2 ②NH4Cl③CH3COONH4④NH3?H2O,c(NH4+)由大到小的顺序是①>②>③>④ |
| B、室温下,向0.01mol/LNH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| C、25℃时,0.1mol/LCH3COOH溶液V1 mL和0.1mol/L NaOH溶液V2mL混合,若V1>V2,则混合溶液的pH一定小于7 |
| D、对于反应N2H4(l)=N2(g)+2H2(g)△H=-50.6kJ/mol,在任何温度下都能自发进行 |
在10mL 0.01mol/L的纯碱溶液中,不断搅拌并逐渐加入1.2mL0.05mol/L盐酸,完全反应后,在标准状况下生成二氧化碳的体积为( )
| A、1.344mL |
| B、2.240mL |
| C、0.672mL |
| D、0mL |
关于氯气跟水的反应,正确的说法是( )
| A、属于复分解反应 |
| B、属于化合反应 |
| C、反应前后,氯元素的化合价一部分升高,一部分降低,其他元素化合价无变化 |
| D、上述说法都不正确 |
为了鉴别某白色纺织品的成分是真蚕丝(蛋白质)还是“人造丝”(合成纤维),可选用的方法是( )
| A、滴加浓硝酸 | B、滴加浓硫酸 |
| C、滴加酒精 | D、灼烧 |
钛(Ti相对原子质量为48)是一种活泼金属,有人预测,钛将是二十一世纪的“明星金属”.工业制备金属钛是以金红石为原料,发生的反应是:反应Ⅰ:aTiO2+bCl2+cC
aTiCl4+cCO 反应Ⅱ:TiCl4+2Mg
Ti+2MgCl2 关于反应Ⅰ、Ⅱ的下列说法中正确的是( )
| ||
| ||
| A、反应Ⅰ中的TiO2是氧化剂 |
| B、TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂 |
| C、a=b=c=2 |
| D、每生成9.6gTi,反应Ⅰ、Ⅱ中共转移0.8mol电子 |