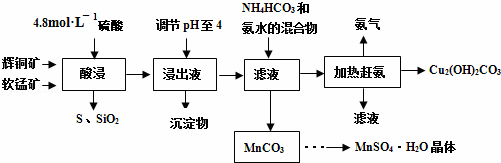
题目内容
20.金属的表面处理可以使金属制品美观耐用,我国2000多年前就已经掌握化学镀铬即铬盐氧化处理技术,现代工业中常采用电镀或化学镀进行金属表面处理.请回答:(l)化学镀是借助合适的还原剂,使镀液中金属离子还原沉积到金属表面.如化学镀镍是在酸性环境下以NaH2PO2为还原剂(氧化生成NaH2PO3)使Ni2+还原,其离子方程式为Ni2++H2PO2-+H2O=Ni+H2PO3-+2H+
(2)工业上进行电镀时,待镀金属作为阴极.电镀铬若采用Cr3+的简单水溶液,电镀过程中阴极附近的pH与电镀时间的关系如图1,pH变化的原因是H+参与放电,上述过程的发生对镀层产生的影响是镀层变薄且不均匀.
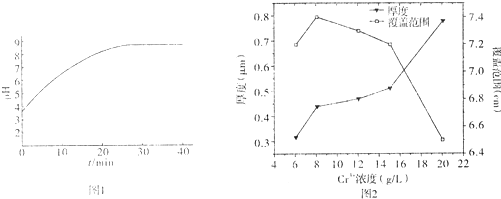
(3)为防止上述过程发生,电镀铬可以在硫酸盐溶液体系中进行,图2为硫酸盐溶液中Cr3+的浓度对镀层厚度和覆盖范围的影响,随厚度增加,镀层覆盖范围变化的原因可能是Cr3+浓度增加会使镀层加厚,但浓度增加铬晶粒变大使覆盖范围变小.
(4)综合考虑镀层厚度及覆盖范围,电镀铬时温度以30-40℃为佳,工业上控制反应温度的设备名称为热交换器;电镀铬的过程中阳极会产生部分Cr2O72+,可以加入AB(填字母)除去.
A.H2O2 B.Na2SO3 C.FeSO4
(5)工业采用含Cr3+为3.25g/L的电解液电镀铬,则溶液pH不能大于4.(已知:35℃时,Kw=2.0×10-14,Ksp[Cr(OH)3]=5.0×10-31)
分析 (1)化学镀镍是在酸性环境下以NaH2PO2为还原剂(氧化生成NaH2PO3)使Ni2+还原,还原产物是Ni,据此书写离子反应;
(2)在电镀工业中,待镀金属做阴极,镀层金属做阳极,根据电镀池中电极反应式来回答;
(3)根据硫酸盐溶液中Cr3+的浓度对镀层厚度和覆盖范围的影响关系来分析原因;
(4)工业上控制反应温度的设备名称为热交换器,Cr2O72-具有很强的氧化性,可以和还原性的试剂之间发生反应,但是不能引进杂质离子;
(5)根据Ksp[Cr(OH)3]=5.0×10-31=c(Cr3+)•c3(OH-)来计算氢氧根离子浓度,根据Kw=c(H+)•c(OH-)来计算氢离子浓度,进而计算pH.
解答 解:(1)根据信息:化学镀镍是在酸性环境下以NaH2PO2为还原剂(氧化生成NaH2PO3)使Ni2+还原,还原产物是Ni,结合氧化还原反应知识,得到反应为:Ni2++H2PO2-+H2O=Ni+H2PO3-+2H+;故答案为:Ni2++H2PO2-+H2O=Ni+H2PO3-+2H+;
(2)在电镀工业中,待镀金属做阴极,镀层金属做阳极,根据电镀过程中阴极附近的pH与电镀时间的关系图,可以看出由于H+参与放电,导致溶液pH的变化,在阴极上,应该是金属阳离子得电子析出金属单质的过程,由于氢离子参与放电,所以镀层变薄且不均匀;故答案为:阴;H+参与放电;镀层变薄且不均匀;
(3)根据硫酸盐溶液中Cr3+的浓度对镀层厚度和覆盖范围的影响关系,得到:Cr3+浓度增加会使镀层加厚,但浓度增加铬晶粒变大使覆盖范围变小,故答案为:Cr3+浓度增加会使镀层加厚,但浓度增加铬晶粒变大使覆盖范围变小;
(4)工业上控制反应温度的设备名称为热交换器;镀铬的过程中阳极会产生部分Cr2O72-,Cr2O72-具有很强的氧化性,可以和还原性双氧水、亚硫酸钠之间发生反应,但是C选项的硫酸亚铁会引进杂质离子,故选AB;
故答案为:热交换器;AB;
(5)含Cr3+为3.25g/L的电解液中,Cr3+的浓度是$\frac{\frac{3.25g}{52g/mol}}{1L}$=0.0625mol/L,根据Ksp[Cr(OH)3]=5.0×10-31=c(Cr3+)•c3(OH-),得到氢氧根离子浓度=$\root{3}{\frac{5.0×1{0}^{-31}}{0.0625}}$=2×10-10mol/L,Kw=c(H+)•c(OH-),c(H+)=$\frac{2×1{0}^{-14}}{2×1{0}^{-10}}$mol/L=10-4mol/L,所以pH=4,故答案为:4.
点评 本题涉及电解池的工作原理以及应用、难溶物的沉淀溶解平衡常数的计算等方面的知识,属于综合知识的考查,难度中等.

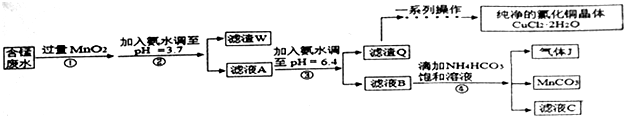
已知:几种金属离子沉淀的pH如表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
(1)过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
(2)过程②中,所得滤渣W的成分是Fe(OH)3和过量的MnO2.
(3)过程③中,调pH=6.4目的是使Cu2+ 完全沉淀为Cu(OH)2.
(4)过程④中,若生成的气体J可使澄清的石灰水变浑浊,则生成MnCO3反应的离子方程式是Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(5)将滤渣Q溶解在过量的盐酸中,经过加热浓缩,降温结晶,过滤、洗涤、低温烘干,即可获得纯净的氯化铜晶体(CuCl2•2H2O).
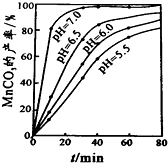
(6)过程④中,298K、c(Mn2+)为1.05mol/L时,实验测得MnCO3的产率与溶液pH、反应时间关系如图据图中信息,你选择的最佳pH是7.0;理由是pH等于7.0时反应速率最快,且MnCO3产率最高.
(7)从滤液C可得到的副产品是NH4Cl(填化学式).
| A. | 含有大量Fe2+的溶液:Na+、SO42+、NH4+、Fe(CN)63- | |
| B. | 使甲基橙变红的溶液:NH4+、CH3COO一、SO42+、Mg2+ | |
| C. | 某无色溶液:OH一、K+、ClO一、Ba2+ | |
| D. | 含有大量NO3-的溶液:K+、I一、NH4+、H+ |
| A. | 将5 mL 0.02 mol/L的H2SO4溶液与5 mL 0.02 mol/L NaOH溶液充分混合,若混合后溶液的体积为10 mL,则混合液的pH=2 | |
| B. | 某物质的溶液中由水电离的c(H+)=1×10-a mol/L,若a>7,则pH一定为14-a | |
| C. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液,c(Na+)大小关系:①>③>② | |
| D. | CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |