题目内容
相对分子质量由小到大排列的X、Y、Z三种气体单质,组成这三种单质的元素分别位于不同的短周期.在一定条件下,X与Y化合生成M;X与Z化合生成N;M能与N化合生成A.实验室可分别用如图1所示的发生装置制取X、Z和M(夹持装置已略).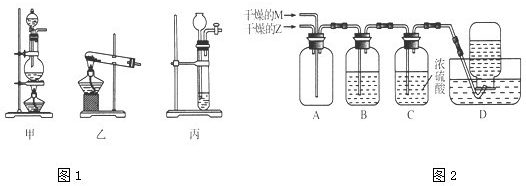
(1)制取X、Z、M的发生装置分别是(填写序号)X: ;Z: ;M: .
(2)X、Y、Z三种单质分别是X: ;Y: ;Z: .(填名称)
(3)A的电子式是 ,A中含有的化学键类型有 .
(4)已知Z能与M在常温下反应生成Y,同时有白烟产生.反应的化学方程式是 .
(5)用如图2所示装置进行Z与M在常温下反应的实验,并收集Y.
①若从A中逸出的气体含有Z,则通入反应装置A中的Z和M的物质的量之比应满足 .
②若从A中逸出的气体无论含有Z或M,经洗气瓶B后,均能被吸收,则洗气瓶B中试剂与Z、M反应的离子方程式分别是 ; .

(1)制取X、Z、M的发生装置分别是(填写序号)X:
(2)X、Y、Z三种单质分别是X:
(3)A的电子式是
(4)已知Z能与M在常温下反应生成Y,同时有白烟产生.反应的化学方程式是
(5)用如图2所示装置进行Z与M在常温下反应的实验,并收集Y.
①若从A中逸出的气体含有Z,则通入反应装置A中的Z和M的物质的量之比应满足
②若从A中逸出的气体无论含有Z或M,经洗气瓶B后,均能被吸收,则洗气瓶B中试剂与Z、M反应的离子方程式分别是
考点:性质实验方案的设计,实验装置综合
专题:实验设计题,元素及其化合物
分析:通过题干选项推出位于三个不同周期三种单质反应,其中两种产物又可相互化合,则可以判断出X、Y、Z三种气体单质分别是H2、N2、Cl2,从而判断出M、A、N的名称;在B洗气瓶中既能吸收Cl2又能吸收NH3的试剂且让写出离子方程式,则说明所选试剂既能与Cl2反应,又能与NH3反应,因此可推测FeCl2溶液,形成氯气、氨气与氯化亚铁溶液反应的离子方程式.
解答:
解:相对分子质量由小到大排列的X、Y、Z三种气体单质,组成这三种单质的元素分别位于不同的短周期;在一定条件下,X与Y化合生成M、X与Z化合生成N、M能与N化合生成A,则X、Y、Z三种气体单质分别是H2、N2、Cl2,所以N为NH3、N为HCl、A为NH4Cl,
(1)根据分析可知,X为氢气、Z为氯气、M为氨气;装置甲为固+液加热制取气体装置,可以用甲装置制取Z氯气;装置乙为固+固加热制取气体装置,可以用于制取M氨气;丙为固+液不需要加热制取气体装置,可用于制取X氢气,故答案为:丙;甲;乙;
(2)根据分析可知,X为H2、Z为N2、Z为Cl2,故答案为:H2;N2;Cl2;
(3)A是M能与N化合生成的,所以A为NH4Cl,氯化铵为离子化合物的,铵根离子和氯离子都需要标出所带电荷及最外层电子,则氯化铵的电子式为 ,氯化铵中存在铵根离子与氯离子形成的离子键,铵根离子中还存在极性共价键,
,氯化铵中存在铵根离子与氯离子形成的离子键,铵根离子中还存在极性共价键,
故答案为: ;离子键、极性共价键;
;离子键、极性共价键;
(4)Z能与M在常温下反应生成Y,同时有白烟产生,Z为氯气、M为氨气,二者反应生成氯化铵和氮气,反应的化学方程式为:3Cl2+8NH3=6NH4Cl+N2,
故答案为:3Cl2+8NH3=6NH4Cl+N2;
(5)①M为NH3、Z为Cl2,二者反应的方程式为:3Cl2+8NH3=6NH4Cl+N2,从A中逸出的气体含有Z,即氯气过量,则通入反应装置A中的Z和M的物质的量之比应满足:n(Cl2):n(NH3)>
,
故答案为:n(Cl2):n(NH3)>
;
②在B洗气瓶中既能吸收Cl2又能吸收NH3的试剂且让写出离子方程式,则说明B所选试剂既能与Cl2反应,又能与NH3反应,因此可推测B可能为FeCl2溶液,反应的离子方程式为:Cl2+2Fe2+=2Cl-+2Fe3+、Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+,
故答案为:Cl2+2Fe2+=2Cl-+2Fe3+;Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+.
(1)根据分析可知,X为氢气、Z为氯气、M为氨气;装置甲为固+液加热制取气体装置,可以用甲装置制取Z氯气;装置乙为固+固加热制取气体装置,可以用于制取M氨气;丙为固+液不需要加热制取气体装置,可用于制取X氢气,故答案为:丙;甲;乙;
(2)根据分析可知,X为H2、Z为N2、Z为Cl2,故答案为:H2;N2;Cl2;
(3)A是M能与N化合生成的,所以A为NH4Cl,氯化铵为离子化合物的,铵根离子和氯离子都需要标出所带电荷及最外层电子,则氯化铵的电子式为
 ,氯化铵中存在铵根离子与氯离子形成的离子键,铵根离子中还存在极性共价键,
,氯化铵中存在铵根离子与氯离子形成的离子键,铵根离子中还存在极性共价键,故答案为:
 ;离子键、极性共价键;
;离子键、极性共价键;(4)Z能与M在常温下反应生成Y,同时有白烟产生,Z为氯气、M为氨气,二者反应生成氯化铵和氮气,反应的化学方程式为:3Cl2+8NH3=6NH4Cl+N2,
故答案为:3Cl2+8NH3=6NH4Cl+N2;
(5)①M为NH3、Z为Cl2,二者反应的方程式为:3Cl2+8NH3=6NH4Cl+N2,从A中逸出的气体含有Z,即氯气过量,则通入反应装置A中的Z和M的物质的量之比应满足:n(Cl2):n(NH3)>
| 8 |
| 3 |
故答案为:n(Cl2):n(NH3)>
| 8 |
| 3 |
②在B洗气瓶中既能吸收Cl2又能吸收NH3的试剂且让写出离子方程式,则说明B所选试剂既能与Cl2反应,又能与NH3反应,因此可推测B可能为FeCl2溶液,反应的离子方程式为:Cl2+2Fe2+=2Cl-+2Fe3+、Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+,
故答案为:Cl2+2Fe2+=2Cl-+2Fe3+;Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+.
点评:本题考查了性质实验方案的设计,题目难度中等,解答关键在于通过题干信息推出位于三个不同周期三种单质的组成,注意掌握物质性质实验方案的设计原则,试题充分考查了学生的分析、理解能力及化学实验能力.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
相同物质的量浓度的KCl、CaCl2、AlCl3三种溶液的体积比为3:2:1,这三种溶液中Cl-浓度之比是( )
| A、3:4:3 |
| B、1:2:3 |
| C、1:1:1 |
| D、2:3:1 |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A、氢氧燃料电池的负极反应:O2+2H2O+4e-═4OH- |
| B、惰性材料做电极电解饱和食盐水时,阳极的电极反应为:2Cl--2e-═Cl2↑ |
| C、粗铜精炼时,与电源正极相连的是纯铜,电极反应为:Cu-2e-═Cu2+ |
| D、钢铁发生电化学腐蚀的正极反应:Fe-2e-═Fe2+ |
 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容. 你认为该同学的错误步骤有
你认为该同学的错误步骤有