题目内容
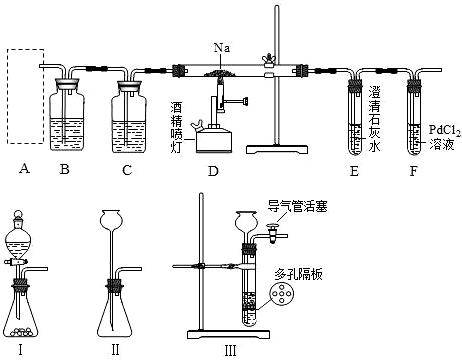
 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先赶出去其中的空气.其中第一步实验操作为:
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为
(3)如何证明E中收集到的是NO而不是H2?
考点:性质实验方案的设计
专题:实验设计题
分析:实验时,可先将B装置中CaCO3放入硝酸中,碳酸钙和硝酸反应生成二氧化碳气体,先排出去其中的空气,以便在E烧瓶中收集到NO,以便观察颜色,且在C中可观察到浑浊,有碳酸钙沉淀生成,A中硝酸和铜反应生成NO,易于氧气反应,则将F气球中空气压入E中,有红棕色气体生成,装置D中盛有氢氧化钠溶液,可用与吸收二氧化氮气体,气体中气球可用于吸收不反应的NO,以防止污染空气,以此解答该题.
解答:
解:(1)实验时,可先将B装置中CaCO3放入硝酸中,碳酸钙和硝酸反应生成二氧化碳气体,先排出去其中的空气,以便在E烧瓶中收集到NO,以便观察颜色,
故答案为:B装置中CaCO3放入硝酸中;
(2)稀硝酸与铜反应生成硝酸铜和NO,反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(3)A中硝酸和铜反应生成NO,易于氧气反应,则将F气球中空气压入E中,有红棕色气体生成,如观察到红棕色,则说明生成NO而不是氢气,
故答案为:将F气球中空气压入E中,有红棕色气体生成,则说明生成NO而不是氢气.
故答案为:B装置中CaCO3放入硝酸中;
(2)稀硝酸与铜反应生成硝酸铜和NO,反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(3)A中硝酸和铜反应生成NO,易于氧气反应,则将F气球中空气压入E中,有红棕色气体生成,如观察到红棕色,则说明生成NO而不是氢气,
故答案为:将F气球中空气压入E中,有红棕色气体生成,则说明生成NO而不是氢气.
点评:本题以硝酸的性质为载体综合考查性质实验的设计,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握相关物质的性质,明确实验目的和原理是解答该题的关键,注意相关实验操作方法的注意事项,难度中等.

练习册系列答案
相关题目
NA表示阿伏加德罗常数.下列说法正确的是( )
| A、标准状况下,2.24LH2O的分子数为0.1NA |
| B、0.1mol Na2O2中含有的阴离子数目为0.2NA |
| C、4.4 g CO2气体中含有的原子总数为0.3NA |
| D、1 L 0.1 mol?L-1 Al2(SO4)3溶液中Al3+的数目为0.2NA |
实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别是( )
| A、1000mL,212g |
| B、950mL,543.4g |
| C、任意规格,572g |
| D、1000mL,286g |
下列关于酸碱反应的说法正确的是( )
| A、常温下,pH=2的HCl与pH=12的NH3?H2O 等体积混合后溶液呈酸性 |
| B、常温下,用pH=2和pH=3的醋酸溶液中和含等量NaOH的溶液所消耗醋酸溶液体积分别为Va,Vb,则Vb<10Va |
| C、常温下,向体积为V1L的浓度均为0.1mol/L HCl、CH3COOH混合溶液中加入 V2L 0.2mol/L的NaOH溶液后,溶液呈中性,则V1>V2 |
| D、常温下,pH为2的硫酸与0.01mol/L的NaOH溶液等体积混合后,混合溶液显酸性 |