题目内容
11.判断下列说法不正确的是( )| A. | 干冰熔化或升华时,CO2分子内的C=O键会被破坏 | |
| B. | 乙炔与氢气反应会变成乙烯,碳原子的杂化类型由sp变为sp2 | |
| C. | 物质的状态变化,只需克服分子间作用力 | |
| D. | 分子中不可能含有离子键 |
分析 A.干冰为分子晶体,熔化或升华时只破坏分子间作用力;
B.乙炔为直线结构,乙烯为平面结构;
C.离子晶体熔化克服离子键,原子晶体熔化克服共价键;
D.含离子键的一定为离子化合物.
解答 解:A.干冰为分子晶体,熔化或升华时只破坏分子间作用力,则CO2分子内的C=O键不变,故A错误;
B.乙炔为直线结构(C为sp杂化),乙烯为平面结构(C为sp2杂化),则碳原子的杂化类型由sp变为sp2,故B正确;
C.离子晶体熔化克服离子键,原子晶体熔化克服共价键,则物质的状态变化,可能化学键断裂,故C错误;
D.含离子键的一定为离子化合物,分子中不可能含有离子键,故D正确;
故选AC.
点评 本题考查化学键及杂化类型,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.

练习册系列答案
相关题目
19.某有机物的一氯代物分子中有两个-CH3,两个-CH2-,一个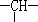 和一个-Cl,则此有机物的结构有( )
和一个-Cl,则此有机物的结构有( )
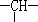 和一个-Cl,则此有机物的结构有( )
和一个-Cl,则此有机物的结构有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
6.下列有关金属铝及其化合物的叙述正确的是( )
| A. | 铝在常温下不能与氧气反应 | |
| B. | 铝合金的强度和硬度都比纯铝的大 | |
| C. | 足量铝分别与含1 mol HCl、1 mol NaOH的溶液反应,产生相同量的氢气 | |
| D. | 铝在常温下不能与冷的浓硫酸和浓硝酸反应 |
16.下列有关NH4Fe(SO4)2水溶液的叙述正确的是( )
| A. | 该溶液中,H+、Mg2+、NO3-、Cl-可以大量共存 | |
| B. | 该溶液能使红色石蕊试纸变蓝,也能使淀粉碘化钾试纸变蓝 | |
| C. | 该溶液和足量Ba(OH)2溶液反应的离子方程式为:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | 该溶液与过量锌粉反应的离子方程式为:Zn+2Fe3+═2Fe2++Zn2+ |
3.下列物质含有的化学键类型完全相同的是( )
| A. | NaBr和H2O | B. | Na2O和Na2O2 | C. | D2O和CO2 | D. | NH4Cl和HCl |
20.下列有关叙述正确的是( )
| A. | 甲烷的二氯代物的同分异构体有两种 | |
| B. | 苯、乙醇和乙酸都能发生取代反应 | |
| C. | 石油分馏的目的是生产乙烯、丙烯、甲烷等化工原料 | |
| D. | 乙酸和乙醇生成乙酸乙酯的反应属于酸碱中和反应 |
 +2H2O.
+2H2O.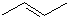 某有机物X的键线式为
某有机物X的键线式为 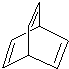
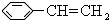 ,该芳香烃Z在一定条件下可发生聚合反应,写出其反应的化学方程
,该芳香烃Z在一定条件下可发生聚合反应,写出其反应的化学方程 .
.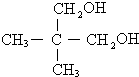 .
.