题目内容
6.下列有关金属铝及其化合物的叙述正确的是( )| A. | 铝在常温下不能与氧气反应 | |
| B. | 铝合金的强度和硬度都比纯铝的大 | |
| C. | 足量铝分别与含1 mol HCl、1 mol NaOH的溶液反应,产生相同量的氢气 | |
| D. | 铝在常温下不能与冷的浓硫酸和浓硝酸反应 |
分析 铝为活泼金属,在常温下就能在表面形成氧化膜、铝既能与酸又能与碱反应,常温下,铝可与浓硫酸、浓硝酸发生钝化反应,在表现生成一层致密的氧化膜,以此解答该题.
解答 解:A.铝常温下在空气中能与氧气反应,表面形成一层氧化膜,故A错误;
B.合金的硬度与强度比各组分的高,铝合金的强度和硬度都比纯铝的大,故B正确;
C.依据铝和酸、碱反应的定量关系计算分析,2Al+6H+=2Al3++3H2↑,2Al+2OH-+2H2O=2AlO2-+3H2↑,与1molHCl、l mol NaOH的溶液反应,分别生成氢气0.5mol、1.5mol,产生相氢气量不同,故C错误;
D.铁和铝在常温下,在浓硫酸和浓硝酸中发生钝化,表面形成一层致密的氧化物薄膜阻止反应进行,故D错误.
故选B.
点评 本题考查铝的性质,为高频考点,侧重于化学与生产、生活的考查,有利于培养学生的良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
16.关于烷烃的叙述不正确的是( )
| A. | 分子式符合CnH2n+2的烃一定是烷烃 | |
| B. | 烷烃均能与氯水发生取代反应 | |
| C. | 正戊烷的熔沸点比异戊烷的高 | |
| D. | 烷烃不能被酸性高锰酸钾等强氧化剂氧化 |
17.下列物质中,可一次性鉴别乙酸、乙醇、苯及氢氧化钡溶液的是( )
①金属钠②溴水③碳酸钠溶液④紫色石蕊试液.
①金属钠②溴水③碳酸钠溶液④紫色石蕊试液.
| A. | ①②③④均可 | B. | 只有①②④ | C. | 只有②③④ | D. | 只有③④ |
14.据报道,摩托罗拉公司研制了一种有甲醇和氧气,以及强碱作电解质的手机电池,电量可达到镍氢电池的10倍,有关此电池的叙述错误的是( )
| A. | 溶液中的阳离子移向正极 | |
| B. | 负极反应式:CH3OH+8OH--6e-═C+6H2O | |
| C. | 电池在使用过程中,电解质溶液的c(OH-)不变 | |
| D. | 当外电路通过6 mol电子时,理论上消耗1.5 mol O2 |
1.现有部分短周期元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代,这种同位素的中子数是8.
(2)元素Y与R形成一种离子YR${\;}_{4}^{+}$,写出该微粒的电子式: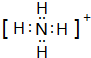 (用元素符号表示).它们还可以形成分子YR3,写出实验室制取该物质的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑
(用元素符号表示).它们还可以形成分子YR3,写出实验室制取该物质的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是②.
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应.
| 元素编号 | 元素性质或原子结构 |
| R | 原子半径最小的元素 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)元素Y与R形成一种离子YR${\;}_{4}^{+}$,写出该微粒的电子式:
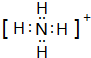 (用元素符号表示).它们还可以形成分子YR3,写出实验室制取该物质的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑
(用元素符号表示).它们还可以形成分子YR3,写出实验室制取该物质的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是②.
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应.
11.判断下列说法不正确的是( )
| A. | 干冰熔化或升华时,CO2分子内的C=O键会被破坏 | |
| B. | 乙炔与氢气反应会变成乙烯,碳原子的杂化类型由sp变为sp2 | |
| C. | 物质的状态变化,只需克服分子间作用力 | |
| D. | 分子中不可能含有离子键 |
18.元素周期表和元素周期律可以指导人们进行规律性的推测和判断.下列说法不合理的是( )
| A. | 短周期元素正化合价数值和其族序数相同 | |
| B. | 人们可在周期表的过渡元素中寻找催化剂和耐腐蚀、耐高温的合金材料 | |
| C. | 由水溶液的酸性:HCl>HF,不能推断出元素的非金属性:F>Cl | |
| D. | 短周期元素形成的微粒X2-与 Y2+核外电子排布相同,离子半径:X2->Y2+ |


