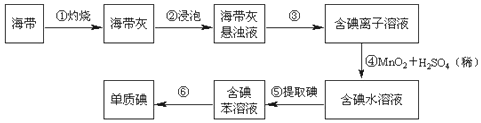
题目内容
9.酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,下列说法正确的是( )| A. | NaHB的存在抑制了水的电离 | |
| B. | HB-水解方程式:HB-+H2O?H3O++B2- | |
| C. | 相同物质的量浓度溶液的pH值:NaHB>Na2B | |
| D. | 溶液中离子浓度大小为:c(Na+)>c(HB-)>c(OH-)>c(H+) |
分析 A.含有弱根离子的盐促进水电离;
B.该方程式为电离方程式;
C.多元弱酸的盐溶液,第一步水解程度大于第二步;
D.酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,则该溶液中c(OH-)>c(H+),溶液呈碱性,钠离子不水解,HB-水解,但水解程度较小.
解答 解:A.含有弱根离子的盐促进水电离,则NaHB的存在促进了水的电离,故A错误;
B.该方程式为电离方程式,HB-水解方程式:HB-+H2O?H2B+OH-,故B错误;
C.多元弱酸的盐溶液,第一步水解程度大于第二步,酸根离子水解程度越大,其相同浓度的盐溶液碱性越强,所以相同物质的量浓度溶液的pH:Na2B>NaHB,故C错误;
D.酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,则该溶液中c(OH-)>c(H+),溶液呈碱性,钠离子不水解,HB-水解,但水解程度较小,所以c(Na+)>c(HB-),溶液中离子浓度大小为:c(Na+)>c(HB-)>c(OH-)>c(H+),故D正确;
故选D.
点评 本题考查了盐类水解,根据酸式酸根离子水解程度和电离程度的相对大小确定溶液的酸碱性,再水解的离子、水解程度大小等知识点来分析解答,注意电离和水解方程式的区别,题目难度中等.

练习册系列答案
相关题目
20.下列关于含有NH4+溶液的叙述正确的是( )
| A. | 等浓度的下列溶液①(NH4)2CO3、②(NH4)2SO4、③(NH4)2FeSO4 ④NH3•H2O,NH4+浓度大小顺序: ④>③>②>① | |
| B. | PH值相同的①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中,NH4+浓度大小顺序:③>②>① | |
| C. | 等浓度的①CH3COONH4 ②NH4HCO3 ③(NH4)2CO3PH大小关系:③>②>① | |
| D. | 等浓度等体积NH4Cl与NH3.H2O混合液的物量守恒:c(NH4+)+c(NH3.H2O)=c(Cl-) |
17.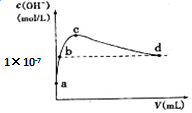 常温下,向1 L pH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )
常温下,向1 L pH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )
 常温下,向1 L pH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )
常温下,向1 L pH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )| A. | d点溶液中:c(Na+)═2c(CO32-)+c(HCO3-) | |
| B. | c点溶液中:c(Na+)>c(HCO3-)>c(CO32-) | |
| C. | b点溶液中:c(H+)=1×10-7mol•L-1 | |
| D. | a点溶液中:水电离出的c(H+)=1×10-10mol•L-1 |
4.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| B. | 已知C(s)+O2(g)═CO2(g)△H1 C(s)+$\frac{1}{2}$O2(g)=CO(g)△H2;则△H2>△H1 | |
| C. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol | |
| D. | 放热过程(△H<0)或熵增加(△S>0)的过程一定是自发的 |
1.下列依据热化学方程式得出的结论正确的是( )
| A. | 等质量的硫磺固体和硫蒸气分别完全燃烧,后者放出的热量多 | |
| B. | △H>0表示放热反应,△H<0表示吸热反应 | |
| C. | △G>0表示反应可自发 | |
| D. | 氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(g),△H=-571.6 kJ/mol |
18.下列关于元素金属性与非金属性的说法正确的是( )
| A. | 元素X位于元素Y的上一个周期,则元素X的非金属性元素比元素Y强 | |
| B. | 测定相同条件下的Na2CO3和Na2SO4的pH,可以比较碳与硫的非金属性强弱 | |
| C. | 非金属性元素的最高价氧化物对应的水化物稳定性越强,则非金属性越强 | |
| D. | 发生氧化还原反应时,X原子失去的电子比Y原子多,证明X的金属性一定比Y强 |
19.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 摩尔是国际单位制七个基本物理量之一 | |
| B. | 1 L 0.1 mol/L BaCl2溶液中所含的Cl-为0.1 NA | |
| C. | 常温常压下,11.2 L Cl2所含的分子数为0.5 NA | |
| D. | 常温常压下,32 g O2含有的氧原子数为2 NA |