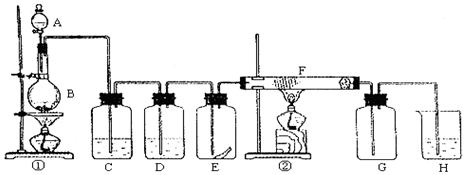
题目内容
9.化学无处不在,与化学有关的说法不正确的是( )| A. | 绚丽缤纷的烟花中可能添加了含钾、钠、钙、铜等某些金属元素的物质 | |
| B. | 回收废弃塑料制成燃油替代汽油、柴油,可减轻环境污染和节约化石能源 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开友废电池的综合利用技术 | |
| D. | 生铁炼钢时必须完全除去生铁中的碳,以避免因钢铁中含有碳而发生电化学腐蚀 |
分析 A.依据焰色反应解答;
B.废塑料通常采用热解油化技术加以回收,即通过加热或加入一定的催化剂使废塑料分解,获得新的燃料汽油、燃料油气等;
C.电池中含有铅、镉等重金属,容易造成环境污染;
D.生铁炼钢的过程中,含碳量在减少,但不能完全除去.
解答 解:A.烟花中添加含钾、钠、钙、铜等某些金属元素的化合物,燃放时发生焰色反应而呈现绚丽缤纷的颜色,故A正确;
B.回收废弃塑料制成燃油替代汽、柴油,可减轻环境污染和节约化石能源,故B正确;
C.电池中含有铅、镉等重金属,容易造成环境污染,应积极开友废电池的综合利用技术,故C正确;
D.生铁炼钢的过程中,含碳量在减少,但不能完全除去,所以不可避免因钢铁中含有碳而发生电化学腐蚀,故D错误;
故选:D.
点评 本题考查了化学与生产生活,熟悉焰色反应原理、明确生活中常见环境污染与治理方法、熟悉炼铁原理是解题关键,题目难度不大.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
19.下列化学用语正确的是( )
| A. | 中子数为18的硫原子:${\;}_{16}^{34}S$ | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | H2O2的电子式: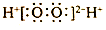 | D. | 乙烯的结构简式:CH2CH2 |
20.对室温下10mL pH=3的醋酸溶液作如下改变时,说法正确的是( )
| A. | 加水稀释到原体积的10倍,溶液的pH=4 | |
| B. | 加水稀释,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变,n(OH-)增大 | |
| C. | 加入10 mL pH=11的NaOH溶液,所得混合液的pH=7 | |
| D. | 加入少量醋酸钠固体,则平衡CH3COOH?CH3COO-+H+逆向移动,K变小 |
4.影响化学反应速率的因素很多,同学们用以下实验的进行探究.
(1)实验一:经研究知Fe3+、Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验(其它实验条件相同).

①定性分析:如图甲可通过观察产生气泡的快慢来比较反应速率的大小,比较得出结论.若图甲所示的实验中反应速率为左边>右边,能否一定说明Fe3+比Cu2+对H2O2分解的催化效果更好否(填“能”或“否”),其理由是两催化剂的阴离子不同(若能说明催化效果,此空不填).
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.用简单的方法检验该装置的气密性关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,如活塞复原则装置的气密性良好.实验中需要测量的数据是:产生40ml气体所需的反应时间.
(2)实验二:高锰酸钾酸性(稀硫酸酸化)溶液和草酸(H2C2O4)溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显但不久突然褪色,反应速率明显加快.
①写出酸性高锰酸钾溶液和草酸溶液反应的化学方程式:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑.
②针对上述实验现象,某同学认为KMnO4与草酸的反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是催化剂的影响.
若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是B.(填序号)
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
(3)实验三 已知 KI溶液在酸性条件下能与氧气反应. 现有以下实验记录:
①该反应的离子方程式为4H++4I-+O2═2I2+2H2O.
②完成此实验,试剂除了1mol/L KI溶液、0.1mol/L H2SO4溶液外,还需要的试剂是淀粉溶液,实验现象为无色溶液变蓝色.
③由上述实验记录数据可得出的结论是其他条件不变,每升高100C,反应速率大增大2倍.
(1)实验一:经研究知Fe3+、Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验(其它实验条件相同).

①定性分析:如图甲可通过观察产生气泡的快慢来比较反应速率的大小,比较得出结论.若图甲所示的实验中反应速率为左边>右边,能否一定说明Fe3+比Cu2+对H2O2分解的催化效果更好否(填“能”或“否”),其理由是两催化剂的阴离子不同(若能说明催化效果,此空不填).
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.用简单的方法检验该装置的气密性关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,如活塞复原则装置的气密性良好.实验中需要测量的数据是:产生40ml气体所需的反应时间.
(2)实验二:高锰酸钾酸性(稀硫酸酸化)溶液和草酸(H2C2O4)溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显但不久突然褪色,反应速率明显加快.
①写出酸性高锰酸钾溶液和草酸溶液反应的化学方程式:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑.
②针对上述实验现象,某同学认为KMnO4与草酸的反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是催化剂的影响.
若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是B.(填序号)
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
(3)实验三 已知 KI溶液在酸性条件下能与氧气反应. 现有以下实验记录:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度(℃) | 30 | 40 | 50 | 60 | 70 |
| 显色时间(s) | 160 | 80 | 40 | 20 | 10 |
②完成此实验,试剂除了1mol/L KI溶液、0.1mol/L H2SO4溶液外,还需要的试剂是淀粉溶液,实验现象为无色溶液变蓝色.
③由上述实验记录数据可得出的结论是其他条件不变,每升高100C,反应速率大增大2倍.
14.事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 ( )
| A. | C(s)+H2O(g)=CO(g)+H2(g)△H>0 | B. | NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0 | ||
| C. | 2CO(g)+O2(g)=2CO2(1)△H<0 | D. | 2H2(g)+O2(g)═2H2O(l)△H<0 |
18.下列说法错误的是( )
| A. | 置换反应一定是氧化还原反应 | |
| B. | 有单质参加的反应一定是氧化还原反应 | |
| C. | 分解反应可能是氧化还原反应 | |
| D. | 凡是氧化还原反应都不可能是复分解反应 |