题目内容
用惰性电极电解足量的下列电解质溶液,一段时间后,两极上均有无色气体产生的是( )
| A、NaCl |
| B、CuSO4 |
| C、Na2SO4 |
| D、HCl |
考点:电解原理
专题:电化学专题
分析:根据离子的放电顺序判断电解实质.
解答:
解:当两极上均有无色气体产生,说明阴极只能产生氢气,溶液中的阳离子的氧化性都比氢离子弱,阳极只能产生氧气,其电解的实质就是电解水型,
A.用惰性电极电解NaCl溶液时,阴极是H+得到电子产生氢气,阳极是Cl-失去电子产生氯气呈黄绿色,故A错误;
B.用惰性电极电解CuSO4溶液时,阴极是Cu2+得到电子析出铜,阳极是OH-失去电子产生氧气,故B错误;
C.用惰性电极电解Na2SO4溶液时,阴极是H+得到电子产生氢气,阳极是OH-失去电子产生氧气,故C正确;
D.用惰性电极电解HCl溶液时,阴极是H+得到电子产生氢气,阳极是Cl-失去电子产生氯气呈黄绿色,故D错误;
故选:C.
A.用惰性电极电解NaCl溶液时,阴极是H+得到电子产生氢气,阳极是Cl-失去电子产生氯气呈黄绿色,故A错误;
B.用惰性电极电解CuSO4溶液时,阴极是Cu2+得到电子析出铜,阳极是OH-失去电子产生氧气,故B错误;
C.用惰性电极电解Na2SO4溶液时,阴极是H+得到电子产生氢气,阳极是OH-失去电子产生氧气,故C正确;
D.用惰性电极电解HCl溶液时,阴极是H+得到电子产生氢气,阳极是Cl-失去电子产生氯气呈黄绿色,故D错误;
故选:C.
点评:主要考查电解原理中阴阳两极的放电顺序.

练习册系列答案
相关题目
反应2A(g)?2B(s)+E(g)△H>0,在恒容容器中达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
| A、移走部分A | B、减压 |
| C、增大E的浓度 | D、降温 |
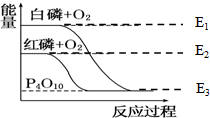 白磷和红磷与氧气反应过程与能量的变化关系如图,E表示能量(单位kJ/mol),则下列说法正确的是( )
白磷和红磷与氧气反应过程与能量的变化关系如图,E表示能量(单位kJ/mol),则下列说法正确的是( )| A、白磷比红磷稳定 |
| B、红磷转变为白磷是吸热反应 |
| C、白磷燃烧是吸热反应 |
| D、红磷燃烧的热化学方程式可表达为:4P(s)+5O2(g)=P4O10(s),△H=-(E3-E2) kJ/mol |
如图为某市售盐酸试剂瓶标签上的部分数据.则该盐酸的物质的量浓度是( )
| 盐酸 化学式:HCl 相对分子质量:36.5 密度:1.18g/cm3 HCl的质量分数:36.5% 符合GB622-89 |
| A、3mol/L |
| B、8.4mol/L |
| C、11.8mol/L |
| D、0.5mol/L |
已知一定温度和压强下,N2(g)和H2(g)反应生成2molNH3(g),放出92.4kJ热量.在同温同压下向密闭容器中通入1molN2和3molH2,达平衡时放出热量为Q1kJ;向另一体积相同的容器中通入2molN2和3molH2,相同温度下达到平衡时放出热量为Q2kJ.则下列叙述正确的是( )
| A、2Q2>Q1=92.4kJ |
| B、2Q2=Q1=92.4kJ |
| C、Q1<Q2<92.4kJ |
| D、2Q2=Q1<92.4kJ |
下列有关实验操作的叙述正确的是( )
| A、为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量 |
| B、进行焰色反应时,所用铂丝先用NaOH溶液洗涤并充分灼烧 |
| C、用托盘天平称取1.06 g无水碳酸钠,溶于250 mL水,配制0.04 mol?L-1 Na2CO3溶液 |
| D、为减小误差,配制溶液时容量瓶必须洗净并烘干后才能使用 |
常温时,下列各组粒子在指定条件下,一定能大量共存的是( )
| A、水电离出c(H+)=10-13mol/L 的溶液中:Fe2+ NO3- k+Cl- |
| B、在NaAlO2溶液中:k+CO32- SO42-S2- |
| C、甲基橙呈红色溶液中:Na+ ClO- Al3+ NO3- |
| D、含FeCl3 溶液中:Cl- k+ H2O2NO3- |
 美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图:
美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图: