题目内容
19.X、Y、Z、W为原子序数依次增大的短周期主族元素,四种元素的周期序数之和为10,X、Y同主族,X的某种核素不含中子,Z的最外层电子数是电子层数的2倍,W在同周期中得电子能力最强,下列说法正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最简单氢化物的稳定性:Z>W | |
| C. | 单质的沸点:Z>W>X | |
| D. | X分别与Y、Z、W形成的化合物的化学键类型相同 |
分析 X、Y、Z、W为原子序数依次增大的短周期主族元素,四种元素的周期序数之和为10,则X只能处于第一周期,Y、Z、W均处于第三周期,X的某种核素不含中子,则X为H元素;X、Y同主族,则Y为Na,Z的最外层电子数是电子层数的2倍,则Z为S,W在同周期中得电子能力最强,则W为Cl.
A.同周期自左而右原子半径减小,所有元素中氢原子半径最小;
B.非金属性越强,对应氢化物越稳定;
C.硫为固体,氯气、氢气为气体,故硫的沸点最高,相对分子质量越大,分子间作用力越强,沸点越高;
D.H2S、HCl中化学键类型为共价键,NaH中化学键类型为离子键.
解答 解:X、Y、Z、W为原子序数依次增大的短周期主族元素,四种元素的周期序数之和为10,则X只能处于第一周期,Y、Z、W均处于第三周期,X的某种核素不含中子,则X为H元素;X、Y同主族,则Y为Na,Z的最外层电子数是电子层数的2倍,则Z为S,W在同周期中得电子能力最强,则W为Cl.
A.同周期自左而右原子半径减小,所有元素中氢原子半径最小,故原子半径:Na>S>Cl>H,故A错误;
B.非金属性W(Cl)>Z(S),则最简单氢化物的稳定性:W>Z,故B错误;
C.硫为固体,氯气、氢气为气体,故硫的沸点最高,氯气相对分子质量大于氢气,氯气分子间作用力更强,沸点高于氢气,故单质的沸点:S>Cl2>H2,故C正确;
D.H2S、HCl中化学键类型为共价键,NaH中化学键类型为离子键,故D错误,
故选:C.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对元素周期律的考查,难度不大.

练习册系列答案
相关题目
10.下列装置所示的实验能达到实验目的是( )
| A. | 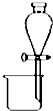 分离碘酒中的碘和酒精 | B. | 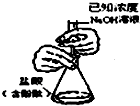 滴定法测定盐酸的浓度 | ||
| C. | 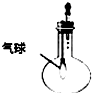 验证NH3的溶解性 | D. | 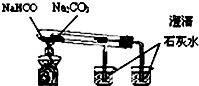 比较Na2CO2、NaHCO2的热稳定性 |
7.下列醇或卤代烃在合适条件下,也不能产生烯烃的是( )
| A. |  | B. | CH3Br | C. |  | D. |  |
14.漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为5HClO2═4ClO2↑+H++Cl-+2H2O(HClO2为弱酸).向NaClO2溶液中滴加H2SO4,开始时HClO2分解反应缓慢,随后反应迅速加快,其原因是( )
| A. | 溶液中的Cl-起催化作用 | |
| B. | 溶液中的H+起催化作用 | |
| C. | ClO2逸出,使反应的生成物浓度降低 | |
| D. | 在酸性条件下,亚氯酸钠的氧化性增强 |
11.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 常温常压下,15gCH3+所含的电子数为9NA | |
| C. | 钠在空气中燃烧可生成多种氧化物.23g钠充分燃烧时转移电子数为1NA | |
| D. | 某密闭容器中盛有0.2mol SO2和0.1mol O2,充分反应,生成SO3分子数为0.2NA |
8.关于维生素的下列说法正确的是( )
| A. | 维生素一般可分为脂溶性和水溶性 | |
| B. | 维生素容易在内积存,主要积存在肝脏 | |
| C. | 维生素容易被人体吸收,多余的随尿排出体外,不易在体内积存,所以容易缺乏 | |
| D. | 维生素C可以防治夜盲症 |
