题目内容
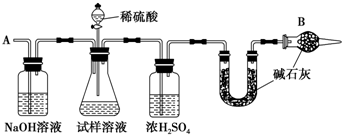
16.下列物质中,能制成太阳能电池的是C,是光导纤维的基本原料的是D,日常生活中常做导线的是A,其合金是用量最大、用途最广的是E,做红色油漆和涂料的是F,做净水剂的是H,具有粘合作用、用作防火剂的是G,作干燥剂的是B.A、铜 B、硅胶 C、硅 D、二氧化硅
E、铁 F、氧化铁 G、硅酸钠 H、硫酸铝钾.
分析 依据硅具有良好的半导体材料,二氧化硅具有良好的光学特性,硅酸钠耐高温不易燃烧,金属具有良好的导电性,硅胶具有吸水性、氧化铁为红色,明矾中铝离子水解生成具有吸附性的氢氧化铝胶体等物质的性质解答.
解答 解:硅具有良好的半导体材料,能制成太阳能电池;二氧化硅具有良好的光学特性,是光导纤维的基本原料;铜具有良好的导电性,日常生活中常做导线;合金是用量最大、用途最广的是铁;氧化铁为红色,可做红色油漆和涂料;明矾中铝离子水解生成具有吸附性的氢氧化铝胶体,能够净水;硅酸钠水溶液具有粘性,耐高温,具有粘合作用、用作防火剂;硅胶具有吸水性,用作干燥剂;
故答案为:C;D;A;E;F;H;G;B.
点评 本题考查了物质的用途,明确相关物质的性质是解题关键,题目难度不大,注意对基础知识的积累.

练习册系列答案
相关题目
6.下列说法正确的是( )
| A. | 向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色 | |
| B. | 欲除去Cl2中少量HCl气体,可将此混合气体通过盛饱和食盐水的洗气瓶 | |
| C. | 漂白粉有效成分是CaCl2和Ca(ClO)2,应密闭保存 | |
| D. | Cl2与水反应生成盐酸和次氯酸的离子方程式为:Cl2+H2O═2H++Cl-+ClO- |
7.下列操作属于萃取的是( )
| A. | 向溴的煤油溶液里加入苯震荡 | B. | 向溴水里加入酒精后震荡 | ||
| C. | 向碘的四氯化碳的溶液里加水震荡 | D. | 向碘水里加入四氯化碳后震荡 |
4.室温下,某实验小组的同学将0.1mol/L的一元酸HA溶液和0.1mol/L的KOH溶液混合(忽略体积变化),实验数据如下表所示,下列判断一定正确的是( )
| 实验编号 | 溶液体积(mL) | 反应后溶液的pH | |
| HA | KOH | ||
| ① | 10 | 10 | |
| ② | 10 | a | 7 |
| A. | 实验①所得的混合溶液中:c(K+)>c(A-)>c(H+)>c(OH-) | |
| B. | 实验①所得的混合溶液中:c(OH-)+c(A-)=c(K+)+c(H+) | |
| C. | 实验②所得的混合溶液中:c(A-)+c(HA)=0.1mol•L-1 | |
| D. | 实验②所得的混合溶液中:(K+)>c(A-)>c(OH-)=c(H+) |
11.若溶液中由水电离产生的C(OH-)=1×10-14 mol•L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
| A. | Al3+ Na+ NO3- Cl- | B. | K+ Na+ Cl- NO3- | ||
| C. | K+ Na+ Cl- AlO2- | D. | K+ ClO- SO42- NO3- |
5.下列有关说法正确的是( )
| A. | 萃取操作时,应选择有机萃取剂,萃取剂的密度不一定比水大 | |
| B. | 检验溶液中是否有SO42-时,加入BaCl2溶液,再加稀硝酸,观察沉淀是否消失 | |
| C. | 以酚酞为指示剂向盐酸中滴加氢氧化钠溶液时,滴定终点时溶液由粉红色恰好变为无色 | |
| D. | 酸式滴定管、碱式滴定管、移液管都是准确量取一定体积液体的容器,它们在使用时都要进行检查是否漏水、水洗、润洗、注液、调整液面等几个过程 |
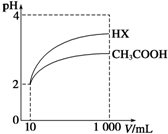 体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+).
体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+).