题目内容
17.研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法不正确的是( )| A. | 负极反应式:Ag+Cl--e-═AgCl | |
| B. | AgCl是氧化产物 | |
| C. | 每生成1 mol Na2Mn5O10转移2 mol电子 | |
| D. | Na+不断向“水”电池的负极移动 |
分析 根据电池总反应可判断出反应中Ag的化合价升高,被氧化,Ag应为原电池的负极,AgCl是氧化产物;方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子;在原电池中阴离子向负极移动,阳离子向正极移动,以形成闭合电路,以此解答该题.
解答 解:A.根据电池总反应:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,可判断出Ag应为原电池的负极,负极发生反应的电极方程式为:Ag+Cl--e-=AgCl,故A正确;
B.反应中Ag的化合价升高,被氧化,Ag应为原电池的负极,AgCl是氧化产物,故B正确;
C.根据方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子,故C正确;
D.在原电池中阴离子向负极移动,阳离子向正极移动,故D错误.
故选D.
点评 本题考查原电池的电极反应和离子的定向移动以及电化学的简单计算,做题时要注意总电池反应式的判断利用,运用两极上的反应特点做题,分析Mn元素的化合价变化是该题的难点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.下列操作属于萃取的是( )
| A. | 向溴的煤油溶液里加入苯震荡 | B. | 向溴水里加入酒精后震荡 | ||
| C. | 向碘的四氯化碳的溶液里加水震荡 | D. | 向碘水里加入四氯化碳后震荡 |
5.下列有关说法正确的是( )
| A. | 萃取操作时,应选择有机萃取剂,萃取剂的密度不一定比水大 | |
| B. | 检验溶液中是否有SO42-时,加入BaCl2溶液,再加稀硝酸,观察沉淀是否消失 | |
| C. | 以酚酞为指示剂向盐酸中滴加氢氧化钠溶液时,滴定终点时溶液由粉红色恰好变为无色 | |
| D. | 酸式滴定管、碱式滴定管、移液管都是准确量取一定体积液体的容器,它们在使用时都要进行检查是否漏水、水洗、润洗、注液、调整液面等几个过程 |
12.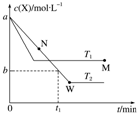 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( )
 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( )| A. | M点时再加入一定量X,平衡后X的转化率减小 | |
| B. | T2下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$ mol•L-1•min-1 | |
| C. | M点的正反应速率v正大于N点的逆反应速率v逆 | |
| D. | 该反应进行到M点放出的热量大于进行到W点放出的热量 |
9.某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失.

下列说法正确的是( )

下列说法正确的是( )
| A. | NaOH溶液可以用氨水来代替 | |
| B. | 溶液a中含有Al3+、K+、Cl-、Na+、OH- | |
| C. | 溶液b中只含有NaCl | |
| D. | 向溶液a中滴加盐酸需控制溶液的pH |
7.下列化学用语正确的是( )
| A. | HSO3-+H2O?SO32-+OH- | B. | Al3++3H2O═3H++Al(OH)3↓ | ||
| C. | NaHCO3═Na++HCO3- | D. | H2S?2H++S2- |
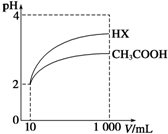 体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+).
体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+).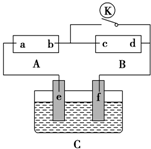 如图所示,A为直流电源,B为浸透饱和硫酸钠溶液和紫色石蕊溶液的滤纸,C为电镀池,接通电路后,发现B上的c点显蓝色,请填空:
如图所示,A为直流电源,B为浸透饱和硫酸钠溶液和紫色石蕊溶液的滤纸,C为电镀池,接通电路后,发现B上的c点显蓝色,请填空: