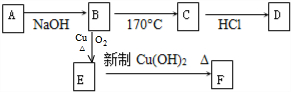
题目内容
已知A、B、C、D四种短周期元素,A、B和C三种元素的原子序数之和等于16.A元素常温下单质为双原子分子,其氢化物水溶液呈碱性,B元素原子的L层上有2对成对电子.C元素可以形成负一价离子.D元素基态原子核外3个能级上有电子,且每个能级上的电子数相等.请回答下列问题:
(1)A元素原子形成单质分子的电子式为 ,DB2的结构式是
(2)B元素原子的价层电子的轨道表示式为 ,
(3)A与C可形成化合物AC3,该化合物的空间构型为 ;实验室制备AC3的化学方程式是
(4)C-与Li+的半径大小的关系是 (用化学式表示)
(5)AC3和 DB2相同条件下两者在水中的溶解度较大的是 (写分子式)
理由是 .
(1)A元素原子形成单质分子的电子式为
(2)B元素原子的价层电子的轨道表示式为
(3)A与C可形成化合物AC3,该化合物的空间构型为
(4)C-与Li+的半径大小的关系是
(5)AC3和 DB2相同条件下两者在水中的溶解度较大的是
理由是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D四种短周期元素,A元素常温下单质为双原子分子,其氢化物水溶液呈碱性,则A为氮元素,B元素原子的L层上有2对成对电子,故B为氧元素;A、B和C三种元素的原子序数之和等于16,故C原子序数为:16-7-8=1,C元素可以形成负一价离子,故C为氢元素;D元素基态原子核外3个能级上有电子,且每个能级上的电子数相等,故D为碳元素,据此解答各小题即可.
解答:
解:A、B、C、D四种短周期元素,A元素常温下单质为双原子分子,其氢化物水溶液呈碱性,则A为氮元素,B元素原子的L层上有2对成对电子,故B为氧元素;A、B和C三种元素的原子序数之和等于16,故C原子序数为:16-7-8=1,C元素可以形成负一价离子,故C为氢元素;D元素基态原子核外3个能级上有电子,且每个能级上的电子数相等,故D为碳元素,依据分析可知:A为氮,B为氧,C为氢,D为碳,
(1)A为氮元素,单质分子的电子式为 ,DB2为CO2,二氧化碳为直线型结构,二氧化碳的结构式为:O=C=O,故答案为:
,DB2为CO2,二氧化碳为直线型结构,二氧化碳的结构式为:O=C=O,故答案为: ;O=C=O;
;O=C=O;
(2)B为O,O原子的价层电子的轨道表示式为 ,故答案为:
,故答案为: ;
;
(3)N与H可形成化合物NH3,该化合物的空间构型为三角锥型,实验是利用氯化铵固体与熟石灰加热制取氨气,化学反应方程式为:2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O,故答案为:三角锥形;2NH4Cl+Ca(OH)2
2NH3>↑+CaCl2+2H2O;
(4)离子核外电子排布相同时,原子序数越小,其半径越大,由于H的原子序数小于Li,半径关系H->Li+,故答案为:H->Li+;
(5)NH3和 CO2相,由于N元素易形成氢键,即氨气分子与水分子间形成氢键,故氨气比二氧化碳易溶于水,所以相同条件下两者在水中的溶解度较大的是:NH3,
故答案为:NH3;氨气分子与水分子间形成氢键.
(1)A为氮元素,单质分子的电子式为
 ,DB2为CO2,二氧化碳为直线型结构,二氧化碳的结构式为:O=C=O,故答案为:
,DB2为CO2,二氧化碳为直线型结构,二氧化碳的结构式为:O=C=O,故答案为: ;O=C=O;
;O=C=O;(2)B为O,O原子的价层电子的轨道表示式为
 ,故答案为:
,故答案为: ;
;(3)N与H可形成化合物NH3,该化合物的空间构型为三角锥型,实验是利用氯化铵固体与熟石灰加热制取氨气,化学反应方程式为:2NH4Cl+Ca(OH)2
| ||
| ||
(4)离子核外电子排布相同时,原子序数越小,其半径越大,由于H的原子序数小于Li,半径关系H->Li+,故答案为:H->Li+;
(5)NH3和 CO2相,由于N元素易形成氢键,即氨气分子与水分子间形成氢键,故氨气比二氧化碳易溶于水,所以相同条件下两者在水中的溶解度较大的是:NH3,
故答案为:NH3;氨气分子与水分子间形成氢键.
点评:本题考查学生原子的组成和结构知识以及元素周期表和元素周期律的应用知识,注意把握原子核外电子的排布规律,题目难度中等.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案
相关题目
下表是元素周期表的一部分.X、Y、Z、W均为短周期元素,Z元素原子最外层电子数与电子总数之比为3:8.下列说法错误的是( )
| X | Y | ||
| Z | W |
| A、Z的气态氢化物比W的气态氢化物稳定 |
| B、原子半径由大到小的顺序为:X>Y |
| C、X元素只能形成一种单质 |
| D、Y元素可形成多种氧化物 |
下列图示实验正确的是( )
A、 分离二氧化锰和氯化锰溶液 |
B、 碳酸氢钠受热分解 |
C、 除去CO气体中的CO2气体 |
D、 配置一定物质的量浓度的溶液 |
 如图是给病人输液用的氯化钠注射溶液的标签.
如图是给病人输液用的氯化钠注射溶液的标签.
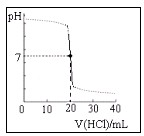 用某浓度的HCl溶液滴定某浓度的NaOH溶液25.00ml,滴定曲线如图所示.则HCl溶液与NaOH溶液的物质的量浓度可能是(单位:mol/L)( )
用某浓度的HCl溶液滴定某浓度的NaOH溶液25.00ml,滴定曲线如图所示.则HCl溶液与NaOH溶液的物质的量浓度可能是(单位:mol/L)( )