题目内容
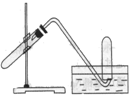
14. 如图所示,在盛有水的烧杯中倒置一支试管,底部有一枚铁钉,放置数天后观察:
如图所示,在盛有水的烧杯中倒置一支试管,底部有一枚铁钉,放置数天后观察:铁钉在逐渐生锈,下列说法中不正确的是( )
| A. | 铁钉生锈,铁钉的腐蚀属于电化学腐蚀腐蚀 | |
| B. | 若试管内液面上升,则铁钉发生的是吸氧腐蚀 | |
| C. | 若试管内液面上升,则铁钉发生的是析氢腐蚀 | |
| D. | 若试管内液面下降,则铁钉发生的是析氢腐蚀 |
分析 A、铁钉中含有碳;
B、吸氧腐蚀时吸收氧气;
C、当溶液显酸性时,发生析氢腐蚀;
D、析氢腐蚀生成氢气.
解答 解:A、铁钉中含有碳,能形成原电池,故发生的是电化学腐蚀,故A正确;
B、吸氧腐蚀时吸收氧气,试管内的压强减小,故液面上升,故B正确;
C、当溶液显酸性时,发生析氢腐蚀,析氢腐蚀生成氢气,试管内的压强增大,故试管内的液面下降,故C错误;
D、析氢腐蚀生成氢气,生成氢气,故会导致试管内的液面下降,故D正确.
故选C.
点评 本题考查了金属的腐蚀和防护,题目难度不大,侧重于基础知识的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.X、Y、Z、W是原子序数依次增大的四种短周期主族元素,其中X、Y同主族,Y、Z、W同周期,X-与氦原子电子层结构相同,Z原子最外层电子数是内层电子总数的一半,W的最高正价与最低负价的代数和为4,下列说法正确的是( )
| A. | X和Y能形成共价化合物 | |
| B. | Y与W形成的化合物Y2W2中含有离子键和共价键 | |
| C. | 简单离子的半径:Y>Z>W>X | |
| D. | 最高价氧化物对应水化物的酸性:Z>W |
5.短周期主族元素X、Y、Z、W的原子序数依次增大,四种元素的原子K层电子数总和为7,L层电子数总和为22,M层电子数总和为12.下列说法正确的是( )
| A. | 最高正价由低到高的顺序为:X、Z、Y、W | |
| B. | 原子半径由小到大的顺序为:X、Y、Z、W | |
| C. | 最外层电子数由少到多的顺序为:X、Z、Y、W | |
| D. | 简单氢化物的稳定性由弱到强的顺序为:Y、Z、W |
2.根据下表信息回答以下问题:
部分短周期元素的原子半径及主要化合价
(1)将A、D、E、F、H对应的简单离子按照半径由小到大的顺序填空Mg2+<Na+<O2-<Cl-<S2-.
(2)B、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是Al(OH)3+3H+=Al3++3H2O.
(3)实验室中制取H单质反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
| 元素 | A | B | C | D | E | F | G | H |
| 原子半径(nm) | 0.130 | 0.118 | 0.090 | 0.102 | 0.073 | 0.154 | 0.037 | 0.099 |
| 主要化合价 | +2 | +3 | +2 | +6,-2 | -2 | +1 | +1 | +7,-1 |
(1)将A、D、E、F、H对应的简单离子按照半径由小到大的顺序填空Mg2+<Na+<O2-<Cl-<S2-.
(2)B、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是Al(OH)3+3H+=Al3++3H2O.
(3)实验室中制取H单质反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
9.如图所示装置可用于(需要时可以用酒精灯加热)( )

| A. | 加热NaHCO3制取和收集CO2 | |
| B. | 用铜和稀硝酸反应制取和收集NO | |
| C. | 用NH4Cl与浓NaOH溶液反应制取和收集NH3 | |
| D. | 用铜和浓硝酸反应制取和收集NO2 |
19.下列说法正确的是( )
| A. | 两种不同元素的原子中,137Cs比131I多6个中子 | |
| B. | 多电子原子中,在离核较远的区域内运动的电子能量较低 | |
| C. | 同主族元素的简单阴离子还原性越强,其氢化物的稳定性越强 | |
| D. | 短周期元素X和Y的原子序数相差2,则X与Y可能同周期,也可能同主族 |
6.下列说法正确的是( )
| A. | pH=6的纯水中,c(OH-)=10-8 mol•L-1 | |
| B. | 向0.1 mol•L-1Na2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大 | |
| C. | 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后溶液pH>7 | |
| D. | 0.1 mol•L-1Na2CO3溶液中c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) |
4.用离子交换法从废钒催化剂(含有V2O5、VOSO4及不溶性残渣)中回收钒工艺的主要流程如图1:

部分含钒物质在水中的溶解性如表:
回答下列问题:
(1)滤液中含钒的主要成分为VOSO4 (填化学式).
(2)反应①的离子方程式为V2O5+SO32-+4H+═VO2++SO42-+2H2O
(3)反应②中1mo1KClO3参加反应,电子转移的数目为6mol
(4)反应③的离子方程为NH4++VO3-=NH4VO3↓,该反应沉钒率的高低除受溶液pH影响外,还需要控制温度.根据图2判断最佳温度为80℃
(5)工业由V2O5,冶炼金属钒常用铝热剂法,该反应的化学方程为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3.

部分含钒物质在水中的溶解性如表:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)滤液中含钒的主要成分为VOSO4 (填化学式).
(2)反应①的离子方程式为V2O5+SO32-+4H+═VO2++SO42-+2H2O
(3)反应②中1mo1KClO3参加反应,电子转移的数目为6mol
(4)反应③的离子方程为NH4++VO3-=NH4VO3↓,该反应沉钒率的高低除受溶液pH影响外,还需要控制温度.根据图2判断最佳温度为80℃
(5)工业由V2O5,冶炼金属钒常用铝热剂法,该反应的化学方程为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3.
 )常用于肉香和海鲜香精配方中.
)常用于肉香和海鲜香精配方中. .
.