题目内容
合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图
2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图

下列说法正确的是
A.t1时升高了温度
B.t2时使用了催化剂
C.t3时增大了压强
D.t4时降低了温度
B
【解析】
试题分析:A、t1时升高了温度,正反应速率增大,而平衡逆向移动,所以正反应速率一直增大直到平衡状态,与图像不符,错误;B、t2时使用了催化剂,反应速率加快为一定值,说明平衡未发生变化,与图像相符,正确;C、t3时增大了压强,正反应速率增大,平衡正向移动,则正反应速率先增大后减小,与图像不符,错误;D、t4时降低了温度,则在t3平衡的基础上,正反应速率先降低后减小,平衡正向移动,与图像不符,错误,答案选B。
考点:考查条件对平衡的影响,平衡移动的判断,图像的分析

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案(12分)在体积不变的2L密闭容器中,进行如下化学反应:CO2(g)+H2(g) 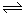 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
t℃ | 500 | 600 | 800 | 900 | 1000 |
K | 0.5 | 0.6 | 1.0 | 1.3 | 1.5 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应正反应为_____反应(选填“吸热”“放热”)。
(3)某温度下,各物质的平衡浓度符合下式:
3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为________。
(4)若800 ℃时,向容器中充入2 mol CO2、2 mol H2,反应进行到5min内,容器内CO的体积分数为20%,则用CO2表示的平均反应速率为 ,达到平衡后,CO2的转化率为 。
(5)800 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡________移动(填“向正反应方向”“向逆反应方向”或“不”)。
 常温下,向20mL 0.lmol?L-1的草酸(H2C204)溶被中不断滴入0.lmol?L-1的KOH溶液,溶液的pH变化曲线如图所示.下列有关说法正确的是
常温下,向20mL 0.lmol?L-1的草酸(H2C204)溶被中不断滴入0.lmol?L-1的KOH溶液,溶液的pH变化曲线如图所示.下列有关说法正确的是( )
| A、a点溶液呈酸性,是因为HC204-的电离程度小于其水解程度 |
| B、b点:c(K+)=c(HC2O4-)+2c(C2O42-) |
| C、c点:c(K+)=c(H2C2O4)+c(HC2O4-)+2c(C2O42-) |
| D、d点:c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+) |

