题目内容
给空气中排放的CO、SO2、NO、NO2、H2S、Cl2都是有毒气体,会造成严重的大气污染,对人类环境造成多方面的破坏,严重影响人文社会的持续性发展.根据下列信息回答有关问题:
(1)CO能使人体 能力降低,造成中毒甚至死亡.
(2)汽车尾气(含CO、NO)处理得到两种无毒气体,化学方程式为 .
(3)SO2是造成酸雨的主要因素,生成酸雨的化学方程式为 .
(1)CO能使人体
(2)汽车尾气(含CO、NO)处理得到两种无毒气体,化学方程式为
(3)SO2是造成酸雨的主要因素,生成酸雨的化学方程式为
考点:常见的生活环境的污染及治理
专题:化学应用
分析:(1)CO与人体的血红蛋白结合,不能与氧气结合,从而导致人因缺氧而死亡.
(2)CO、NO在催化剂的作用下发生反应,转化为两种无毒气体,生成二氧化氮和氮气;
(3)二氧化硫和水反应生成亚硫酸,亚硫酸不稳定易被氧化生成硫酸.
(2)CO、NO在催化剂的作用下发生反应,转化为两种无毒气体,生成二氧化氮和氮气;
(3)二氧化硫和水反应生成亚硫酸,亚硫酸不稳定易被氧化生成硫酸.
解答:
解:(1)CO与人体的血红蛋白结合,不能与氧气结合,从而导致人因缺氧而死亡,故答案为:供氧;
(2)CO、NO在催化剂的作用下发生反应,转化为两种无毒气体,生成二氧化氮和氮气,反应的方程式为2CO+2NO
N2+2CO2,
故答案为:2CO+2NO
N2+2CO2.
(3)二氧化硫和水反应生成亚硫酸,亚硫酸不稳定易被氧化生成硫酸,方程式为:2SO2+2H2O+O2=2H2SO4,故答案为:2SO2+2H2O+O2=2H2SO4.
(2)CO、NO在催化剂的作用下发生反应,转化为两种无毒气体,生成二氧化氮和氮气,反应的方程式为2CO+2NO
| ||
故答案为:2CO+2NO
| ||
(3)二氧化硫和水反应生成亚硫酸,亚硫酸不稳定易被氧化生成硫酸,方程式为:2SO2+2H2O+O2=2H2SO4,故答案为:2SO2+2H2O+O2=2H2SO4.
点评:本题考查较为综合,涉及CO中毒的原理以及环境污染的治理等知识,侧重于学生的分析能力和基础知识的考查的考查,为高频考点,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、C2H2的电子式为H:C:::C:H |
| B、酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| C、鸡蛋白溶液中滴加饱和硫酸铵溶液,出现沉淀,该过程属于蛋白质的盐析 |
| D、6个碳原子形成的烃分子中,最多有5个碳碳单键 |
下列关于热化学反应的描述中正确的是( )
| A、HCl和NaOH反应的中和热△H=-57.3 kJ?mol-1,则H2SO4和NaOH反应的中和热△H=2×(-57.3)kJ?mol-1 |
| B、CO的燃烧热是283kJ?mol-1,则2CO2(g)=2CO(g)+O2(g)△H=2×(+283)kJ?mol-1 |
| C、同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下反应的△H不相同 |
| D、已知:2C(s)+2O2=2CO2(g)△H1,2C(s)+O2=2CO(g)△H2,则△H1>△H2 |
在铁和铜的混合物中加入一定量的稀硝酸,充分反应后剩余金属的质量为m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属的质量为m2g,则m1与m2的关系是( )
| A、m1>m2 |
| B、m1≤m2 |
| C、m1≥m2 |
| D、m1=m2 |
下列叙述不正确的是( )
| A、闪电时,空气中的氮气直接转化为二氧化氮 |
| B、实验室可用浓硫酸干燥二氧化硫 |
| C、不能用稀硝酸和活泼金属反应制氢气 |
| D、将足量二氧化硫通入酸性高锰酸钾试液中,溶液褪色说明二氧化硫具有还原性 |
下列叙述正确的是( )
| A、将稀氨水逐滴加入稀硫酸中,当溶液pH=7,c(SO42-)=c(NH4+) | ||
| B、两种醋酸溶液物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 | ||
| C、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | ||
D、向0.1moL?L-1的氨水中加入少量硫酸铵固体,则溶液中
|
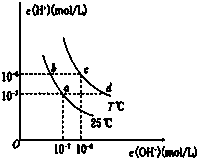 如图表示水溶液中c(H+)与c(OH-)的关系.
如图表示水溶液中c(H+)与c(OH-)的关系.