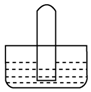
��Ŀ����
4�� ��ͼ��ʾ����ԲȦ�ཻ����Ӱ���ֱ�ʾԲȦ������������ķ�Ӧ���Ƽ�������������ʵ�����Ϊ0.1mol��ˮ������Ϊ100g������˵����ȷ���ǣ�������
��ͼ��ʾ����ԲȦ�ཻ����Ӱ���ֱ�ʾԲȦ������������ķ�Ӧ���Ƽ�������������ʵ�����Ϊ0.1mol��ˮ������Ϊ100g������˵����ȷ���ǣ�������| A�� | �ס��ҡ���������������ԭ��Ӧ | |
| B�� | ��Ӧ�����ӷ���ʽΪNa+2H2O�TNa++2OH-+H2�� | |
| C�� | �ס��ҡ�����ַ�Ӧ��������Һ�����������ֱ�Ϊw1��w2��w3����2w1=w2=w3 | |
| D�� | ����ַ�Ӧ���ܲ���0.05 mol O2��ת�Ƶ���0.1 mol |
���� A�����ݷ�Ӧ���Ƿ��л��ϼ۱仯�жϣ�
B����ɲ��غ㣻
C�����ݹ�������ʵ���������Һ�����ʵ���������Һ����������������������ʽ�ж�����������Դ�С��
D������������ˮ��ӦΪ�绯��Ӧ���������Ƽ������������ǻ�ԭ����
��� �⣺A����Ӧ�д���Ԫ�ػ��ϼ۵ı仯�ķ�Ӧ����������ԭ��Ӧ���ס�������������ԭ��Ӧ������û��Ԫ�ػ��ϼ۵ı仯�����Ҳ���������ԭ��Ӧ����A����
B����Ӧ�����ӷ���ʽΪ2Na+2H2O�T2Na++2OH-+H2������B����
C���ơ������ơ��������ƺ�ˮ��Ӧ�ķ���ʽ�ֱ����£�
Na+H2O=NaOH+$\frac{1}{2}$H2������Һ���ӵ�����=m��Na��-m��H2��=2.3g-0.1g=2.2g��
Na2O+H2O=2NaOH����Һ���ӵ�����=m��Na2O��=0.1mol��62g/mol=6.2g��
Na2O2+H2O=2NaOH+$\frac{1}{2}$O2������Һ���ӵ�����=m��Na2O2��-m��O2��=m��Na2O��=6.2g
������Һ���ӵ�������С˳��Ϊ���ƣ�������=�������ƣ�
������ԭ���غ�֪��0.1mol���ơ������ơ��������ơ�����ˮ�����������Ƶ����ʵ����ֱ�Ϊ��0.1mol��0.2mol��0.2mol��ͨ�����Ϸ�����֪��0.1mol���ơ������ơ��������Ʒֱ�����ˮ������Һ�����������ֱ�Ϊw1=$\frac{4g}{100g+2.2g}$��w2=$\frac{8g}{100g+6.2g}$��w3=$\frac{8g}{100g+6.2g}$����2w1��w2=w3����C����
D������������ˮ��ӦΪ�绯��Ӧ���������Ƽ������������ǻ�ԭ�������ݷ���ʽ��2Na2O2+2H2O=4NaOH+O2��������1mol����ת��2mol���ӣ�������0.05 mol O2��ת�Ƶ���0.1 mol����D��ȷ��
��ѡ��D��
���� ���⿼�����Ƽ��仯��������ʣ�ע�������Һ���������������ļ��㷽����ע�����������ˮ��Ӧ�й������Ƽ������������ǻ�ԭ�����ص��ǽ���ؼ�����Ŀ�Ѷ��еȣ�

| A�� | �� | B�� | ��ϩ | C�� | ˮ | D�� | ���� |

| A�� | װ�â�������ʢװ����ŨH2SO4����ˮ | |
| B�� | ʵ��ʱ��Ӧ�ȼ��ȹ�ʽ¯���ٴ�ʢװϡ����ķ�Һ©�� | |
| C�� | Ϊ�����ƵõĹ����Ƿ��������ʣ���Ҫ�õ����Լ�Ϊ���ᡢ˫��ˮ�����軯����Һ | |
| D�� | ��ʵ�����Ʊ�������װ��Ҳ��������������ϡ��Һ���Ȼ�粒��巴Ӧ�Ʊ����� |
 ������Ԫ��W��X��Y��Z��ԭ������������������ZΪ������Z��ԭ������ΪW��2����n��p��q������ЩԪ����ɵĶ�Ԫ����������£�nΪ���壮m��r��s�ֱ���Z��W��X�ĵ��ʣ�t��ˮ��Һ�ʼ�����ɫ��Ӧ�ʻ�ɫ���������ʼ��ת����ϵ��ͼ��ʾ������˵����ȷ���ǣ�������
������Ԫ��W��X��Y��Z��ԭ������������������ZΪ������Z��ԭ������ΪW��2����n��p��q������ЩԪ����ɵĶ�Ԫ����������£�nΪ���壮m��r��s�ֱ���Z��W��X�ĵ��ʣ�t��ˮ��Һ�ʼ�����ɫ��Ӧ�ʻ�ɫ���������ʼ��ת����ϵ��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | �����Ӱ뾶��Z��Y��X | |
| B�� | ������P��ֻ�������Ӽ� | |
| C�� | ͼʾת����ϵ�漰�ķ�Ӧ��Ϊ������ԭ��Ӧ | |
| D�� | �����̬�⻯����ȶ��ԣ�W��X |
| A�� | ���������ݻ����䣬�����м���1 mol H2��g�����ٽ�ƽ��ʱ��Ӧ����һ���ӿ� | |
| B�� | ���������ݻ����䣬�����м���1 mol N2��N2���μӷ�Ӧ������Ӧ����һ���ӿ� | |
| C�� | ��������������ѹǿ���䣬�����м���1 mol N2��N2���μӷ�Ӧ�����ٴ�ƽ��ʱ��Ӧ����һ���ӿ� | |
| D�� | ��������������ѹǿ���䣬�����м���1 mol H2��g����1 mol I2��g�����ٴ�ƽ��ʱ��Ӧ����һ���ӿ� |
��1����̫���ܽ�CO2ת����O2��C��ʯīϩ������������ͼ1��
��Fe3O4��Fe�Ļ��ϼ���+2��+3��
������ϵͳ������Ӧ�Ļ�ѧ����ʽΪ6FeO+CO2�T2Fe3O4+C��
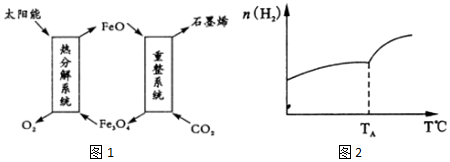
��2��������̼�������ڴ��������¿���ȡ��̼ϩ������һ�ܱ������зֱ�Ͷ��1molCO2��3molH2��������Ӧ��2CO2��g��+6H2��g��?C2H4 ��g��+4H2O��g����H���ڲ�ͬ�¶��£��ô��м������ƽ��ʱH2�����ʵ����仯��ϵ��ͼ2��ʾ��
�������������䣬��ʼʱ����lmolCO2��2molH2����Ͷ�ϣ�CO2ת���ʽ���С�����������С�����䡱����
�ڡ�H��0�������������������ȷ��������
������������ϵ���������������Խ��ͼʾ�ƶ����ȶ���C2H4��H2O �������������������ȷ��������
��3���ð�ˮ����CO2�ƻ��ʣ�NH4HCO3��
����֪��NH3•H2O��aq��?NH4+��aq��+OH-��aq����H1=a kJ•mol-1
CO2 ��g��+H2O��l��?H2CO3 ��aq����H2=bkJ•mol-1
H2CO3��aq��+OH-��aq��?HCO3-��aq��+H2O��l����H3=ckJ•mol-1
������NH3•H2O����CO2�Ʊ�NH4HCO3���Ȼ�ѧ����ʽΪNH3•H2O+CO2�TNH4++HCO3-��H=��a+b+c��kJ/mol��
����֪������������������
| Kb��NH3•H2O�� | 2��10-5mol•L-1 |
| Ka1��H2CO3�� | 4��10-7mol•L-1 |
| Ka2��H2CO3�� | 4��10-11mol•L-1 |


 �������ǻ����飮
�������ǻ����飮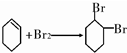 ��
��