题目内容
11.下列有关物质的性质与应用的对应关系正确的是( )| A. | ClO2具有强还原性,可用于自来水的杀菌消毒 | |
| B. | 晶体硅具有导电性,可用于制作光导纤维 | |
| C. | MgO的熔点很高,可用于制作耐高温材料 | |
| D. | 浓硫酸具有吸水性,可用于干燥氯气、氨气等气体 |
分析 A.强氧化性可用于杀菌消毒;
B.二氧化硅具有对光良好的全反射作用,为光导纤维的材料;
C.熔点高的物质可作耐高温材料;
D.浓硫酸具有吸水性,与氨气反应.
解答 解:A.强氧化性可用于杀菌消毒,则ClO2具有强氧化性,可用于自来水的杀菌消毒,故A错误;
B.二氧化硅具有对光良好的全反射作用,为光导纤维的材料,而Si为常见的半导体材料,故B错误;
C.熔点高的物质可作耐高温材料,则MgO的熔点很高,可用于制作耐高温材料,故C正确;
D.浓硫酸具有吸水性,与氨气反应,则浓硫酸可干燥氯气,不能干燥氨气,故D错误;
故选C.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、性质与用途的关系为解答的关键,侧重分析与应用能力的考查,注意性质决定物质的用途,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.下列说法正确的是( )
| A. | 煤的干馏、石油的分馏分别是化学变化、物理变化 | |
| B. | 淀粉和纤维素的化学式均为(C6H10O5)n,二者是同分异构体 | |
| C. | 天然纤维和合成纤维的主要成分都是纤维素 | |
| D. | 饱和(NH4)2SO4溶液和饱和CuSO4溶液都能使蛋白质溶液产生沉淀,其作用原理相同 |
2.烷烃 是单烯烃R和H2发生加成反应后的产物,则R可能的结构有( )
是单烯烃R和H2发生加成反应后的产物,则R可能的结构有( )
 是单烯烃R和H2发生加成反应后的产物,则R可能的结构有( )
是单烯烃R和H2发生加成反应后的产物,则R可能的结构有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
16.下列分散系中,分散质粒子的直径大小在1nm~100nm之间的是( )
| A. | CuSO4溶液 | B. | 豆浆 | C. | 稀硫酸 | D. | 浑浊的石灰水 |
20.表是元素周期表的一部分,针对表中①~⑩种元素,填写下列空白:
(1)被选作相对原子质量标准的核素是12C(填核素符号).
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是KOH.
(3)最高价氧化物是两性氧化物的元素其单质与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)从⑤到⑧的元素中,Al3+离子半径最小(填离子符号).
(5)元素③与⑤形成的具有强氧化性的化合物的电子式 .
.
(6)若要比较⑤比⑥的金属性强弱,下列实验方法可行的是C.
A.将单质⑤置于⑥的盐溶液中,如果⑤不能置换出单质⑥,说明⑤的金属性弱
B.比较⑤和⑥的最高价氧化物对应水化物的水溶性,前者比后者溶解度大,故前者金属性强
C.将⑤、⑥的单质分别投入到水中,观察到⑤与水反应更剧烈,说明⑤的金属性强
D.将⑤、⑥的单质分别在O2中燃烧,前者得到氧化物的颜色比后者得到氧化物的颜色深,则前者金属性强.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是KOH.
(3)最高价氧化物是两性氧化物的元素其单质与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)从⑤到⑧的元素中,Al3+离子半径最小(填离子符号).
(5)元素③与⑤形成的具有强氧化性的化合物的电子式
 .
.(6)若要比较⑤比⑥的金属性强弱,下列实验方法可行的是C.
A.将单质⑤置于⑥的盐溶液中,如果⑤不能置换出单质⑥,说明⑤的金属性弱
B.比较⑤和⑥的最高价氧化物对应水化物的水溶性,前者比后者溶解度大,故前者金属性强
C.将⑤、⑥的单质分别投入到水中,观察到⑤与水反应更剧烈,说明⑤的金属性强
D.将⑤、⑥的单质分别在O2中燃烧,前者得到氧化物的颜色比后者得到氧化物的颜色深,则前者金属性强.
19.运用下列装置和操作能达到实验目的和要求的是( )
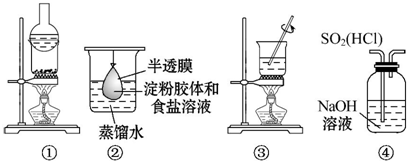

| A. | 用①分离氯化铵和单质碘 | |
| B. | 用②除去淀粉溶液中的氯化钠 | |
| C. | 用③加热胆矾(CuSO4•5H2O)制取无水硫酸铜 | |
| D. | 用④装置除去SO2中的HCl |

 ,食醋中的有机物结构式
,食醋中的有机物结构式 .
.