题目内容
20.表是元素周期表的一部分,针对表中①~⑩种元素,填写下列空白:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是KOH.
(3)最高价氧化物是两性氧化物的元素其单质与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)从⑤到⑧的元素中,Al3+离子半径最小(填离子符号).
(5)元素③与⑤形成的具有强氧化性的化合物的电子式
 .
.(6)若要比较⑤比⑥的金属性强弱,下列实验方法可行的是C.
A.将单质⑤置于⑥的盐溶液中,如果⑤不能置换出单质⑥,说明⑤的金属性弱
B.比较⑤和⑥的最高价氧化物对应水化物的水溶性,前者比后者溶解度大,故前者金属性强
C.将⑤、⑥的单质分别投入到水中,观察到⑤与水反应更剧烈,说明⑤的金属性强
D.将⑤、⑥的单质分别在O2中燃烧,前者得到氧化物的颜色比后者得到氧化物的颜色深,则前者金属性强.
分析 由元素在周期表中的外置,可知①为C、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为Cl、⑨为K、⑩为Ca.
(1)被选作相对原子质量标准的核素是C-12;
(2)在最高价氧化物的水化物中,酸性最强的是高氯酸;金属性越强,最高价氧化物对应水化物的碱性越强;
(3)Al元素的氧化物--氧化铝是两性氧化物,铝与氢氧化钠溶液反应生成偏铝酸钠与氢气;
(4)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多离子半径越大;
(5)元素③与⑤形成的具有强氧化性的化合物为Na2O2;
(6)可以根据金属与水或酸反应的难易程度、剧烈程度,最高价氧化物对应水化物的碱性强弱,金属单质之间相互置换等判断金属性强弱,物理性质不能比较金属性强弱,钠置于盐溶液中首先与水反应,不能置换盐溶液中的金属元素.
解答 解:由元素在周期表中的外置,可知①为C、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为Cl、⑨为K、⑩为Ca.
(1)被选作相对原子质量标准的核素是C-12,该核素符号为12C,故答案为:12C;
(2)在最高价氧化物的水化物中,酸性最强的是高氯酸,化学式为HClO4,上述元素中K的金属性最强,故KOH的碱性最强,故答案为:HClO4;KOH;
(3)氧化铝是两性氧化物,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多离子半径越大,故离子半径:Cl->Na+>Mg2+>Al3+,故答案为:Al3+;
(5)元素③与⑤形成的具有强氧化性的化合物为Na2O2,由钠离子与过氧根离子构成,电子式为: ,故答案为:
,故答案为: ;
;
(6)A.钠首先与水反应,不能置换盐溶液中的金属元素,不能说明Na的金属性比较Mg弱,故A错误;
B.溶解性属于物理性质,不能比较元素金属性强弱,故B错误;
C.金属单质与水反应越剧烈,对应元素的金属性越强,故C正确;
D.物质的颜色属于物理性质,不能比较金属性强弱,故D错误,
故答案为:C.
点评 本题考查元素周期表与元素周期律的综合应用,需要学生熟练掌握元素周期表的结构,注意掌握元素金属性、非金属性比较实验事实.

 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案| A. | ClO2具有强还原性,可用于自来水的杀菌消毒 | |
| B. | 晶体硅具有导电性,可用于制作光导纤维 | |
| C. | MgO的熔点很高,可用于制作耐高温材料 | |
| D. | 浓硫酸具有吸水性,可用于干燥氯气、氨气等气体 |
| A. | Na2O2与水反应:2O22-+2H2O═4OH-+O2↑ | |
| B. | 小苏打与烧碱溶液反应 HCO3-+OH-═CO2↑+H2O | |
| C. | Ca(HCO3)2与过量的NaOH溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 用FeCl3溶液腐蚀铜电路板:Fe3++Cu═Fe2++Cu2+ |
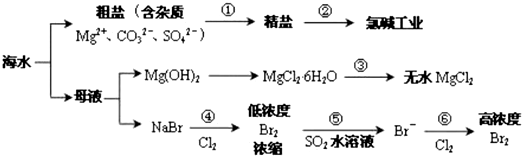
| A. | 过程①除杂的顺序:NaOH 溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程③中将MgCl2•6H2O 灼烧即可制得无水 MgCl2 | |
| C. | 在过程④、⑥反应中每氧化 0.2 mol Br- 需消耗2.24 LCl2 | |
| D. | 从第④步到第⑥步的目的是为了富集溴 |
| A. | 聚乙烯能使溴水褪色 | |
| B. | 葡萄糖能发生氧化反应和水解反应 | |
| C. | CH2═CHCN通过缩聚反应得到腈纶 | |
| D. | 区别棉花和羊毛的最简单方法是灼烧闻气味 |
| A. | Li是负极,电极反应为Li-e-═Li+ | |
| B. | 锂电池属于一次性电池 | |
| C. | MnO2是正极,电极反应为MnO2+e-═MnO${\;}_{2}^{-}$ | |
| D. | 锂电池是一种环保型电池 |
| A. | 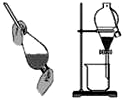 如图装置可用于分离甲苯和液溴的混合物 | |
| B. | 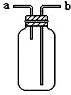 如图装置可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 | |
| C. | 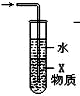 如图装置中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 | |
| D. |  如图装置可用于干燥、收集NH3,并吸收多余的NH3 |